
����Ŀ���ϳɰ��Ի�ѧ��ҵ������ҵ������Ҫ���塣
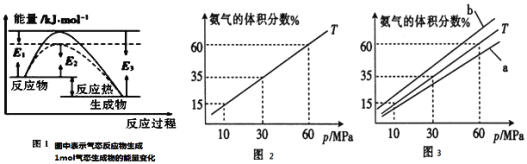
(1)����ͼ1��д���ϳɰ����Ȼ�ѧ����ʽ______![]() ������
������![]() ��
��![]() ��
��![]() ��ʾ
��ʾ![]() ��
��
(2)��ϳ����а����ʵ���֮��l��4����![]() ��
��![]() ���а��ĺϳɣ�ͼ2Ϊ
���а��ĺϳɣ�ͼ2Ϊ![]() ʱƽ�������а��������������ѹǿ
ʱƽ�������а��������������ѹǿ![]() �Ĺ�ϵͼ��
�Ĺ�ϵͼ��
��ͼ2�а������������Ϊ![]() ʱ��
ʱ��![]() ��ת����Ϊ______��
��ת����Ϊ______��
��ͼ3��![]() �����¶�Ϊ
�����¶�Ϊ![]() ʱ��Ӧ��������______
ʱ��Ӧ��������______![]() �a����b��
�a����b��![]() ��
��
(3)�ϳɰ�������������ɼ�����ˮ��Ӧ�Ƶã���Ӧ���Ȼ�ѧ����ʽΪ![]() ��һ���¶��£������Ϊ2L�ĺ��������з���������Ӧ�������ʵ����ʵ����仯�����
��һ���¶��£������Ϊ2L�ĺ��������з���������Ӧ�������ʵ����ʵ����仯�����
ʱ�� |
|
|
|
|
0 |
|
| 0 | 0 |
5 |
|
|
|
|
7 |
|
|
|
|
10 |
|
|
|
|
�ٷ����������ݣ��ж�5minʱ��Ӧ�Ƿ���ƽ��״̬��______![]() ��ǡ���
��ǡ���![]() ��ǰ5min��Ӧ��ƽ����Ӧ����
��ǰ5min��Ӧ��ƽ����Ӧ����![]() ______��
______��
������ͬʵ�������£�����Ϊ����![]() ����Ҫ��ƽ���
����Ҫ��ƽ���![]() �ڷ�Ӧ������������������䣬�����������ʼ������ʵ���Ϊ______��
�ڷ�Ӧ������������������䣬�����������ʼ������ʵ���Ϊ______��
�۷�Ӧ��![]() �ڣ�CO�����ʵ������ٵ�ԭ�������______
�ڣ�CO�����ʵ������ٵ�ԭ�������______![]() ����ĸ
����ĸ![]() ��
��
![]() ����
����![]() �����ʵ���
�����ʵ��� ![]() �����¶�
�����¶� ![]() �����¶�
�����¶� ![]() ����
����![]()
�����з����п���֤�������Ѵ�ƽ��״̬����______��
![]() ��λʱ��������
��λʱ��������![]() ��ͬʱ����
��ͬʱ����![]()
b.������ѹǿ���ٱ仯
![]() ��������ܶȲ��ٱ仯
��������ܶȲ��ٱ仯
![]() ��������ƽ����Է����������ٱ仯
��������ƽ����Է����������ٱ仯
![]() �������������ٱ仯
�������������ٱ仯
����֪̼��������Ӧ�ڲ�ͬ�¶���ƽ�ⳣ���Ķ���ֵ![]() �����
�����
������Ӧʽ | lgK | ||
700K | 900K | 1200K | |
|
|
|
|
|
|
|
|
��Ӧ![]() ��900Kʱ���÷�Ӧƽ�ⳣ���Ķ���ֵ
��900Kʱ���÷�Ӧƽ�ⳣ���Ķ���ֵ![]() ______��
______��
���𰸡�![]()
![]() a ��
a �� ![]()
![]() ��
��![]() ��
��![]() d bde
d bde ![]()
��������
(1)�ʱ�������淴Ӧ�Ļ��֮�ͼ������1mol��������Ϊ![]() ���ϳɰ����Ȼ�ѧ����ʽΪ
���ϳɰ����Ȼ�ѧ����ʽΪ![]() ��
��
(2)����ϳ����а����ʵ���֮��l��4����![]() ��
��![]() ���а��ĺϳɣ���
���а��ĺϳɣ���
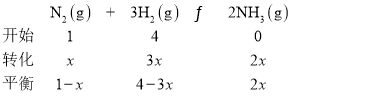
�������������Ϊ![]() ʱ��
ʱ��![]() �����
�����![]() ��������ת����Ϊ
��������ת����Ϊ![]() ��
��
�ںϳɰ�Ϊ���ȷ�Ӧ�������¶�ƽ�������ƶ������������������С�����¶�Խ�߶�Ӧ�������������ԽС��ͼ��T=450�棬���¶�Ϊ500��ʱ��Ӧ��������a��
(3)���ɱ������ݿ�֪��7minʱ���ļ���0.2mol�����ݷ���ʽ������ˮ0.2mol������![]() =0.8mol����5minʱ��ͬ����5minʱΪƽ��״̬��ǰ5min��Ӧ��ƽ����Ӧ����
=0.8mol����5minʱ��ͬ����5minʱΪƽ��״̬��ǰ5min��Ӧ��ƽ����Ӧ���� ��
��
�ں��º��ݣ���Ӧǰ������������ȵķ�Ӧ��Ҫ��ƽ���![]() �ڷ�Ӧ������������������䣬����ת��Ϊ��Ӧ��ʱ����ʼ��Ӧ������ʵ�����ͬ����
�ڷ�Ӧ������������������䣬����ת��Ϊ��Ӧ��ʱ����ʼ��Ӧ������ʵ�����ͬ����
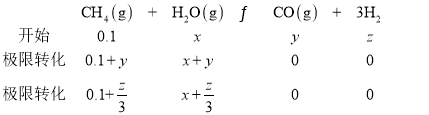
![]() ��
��![]() �����
�����![]() ��
��![]() ��
��![]() ��
��
�۷�Ӧ��![]() �ڣ�CO�����ʵ������٣����������ʵ������ӡ���
�ڣ�CO�����ʵ������٣����������ʵ������ӡ���
a.����![]() �����ʵ�����ƽ�������ƶ���
�����ʵ�����ƽ�������ƶ���![]() �����ʵ���Ӧ�ü�С���ʲ�ѡa��
�����ʵ���Ӧ�ü�С���ʲ�ѡa��
![]() Ϊ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���
Ϊ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���![]() �����ʵ���Ӧ�ü�С���ʲ�ѡb��
�����ʵ���Ӧ�ü�С���ʲ�ѡb��
![]() �����¶ȣ�ƽ�������ƶ���CO�����ʵ������ʲ�ѡc��
�����¶ȣ�ƽ�������ƶ���CO�����ʵ������ʲ�ѡc��
![]() ����
����![]() ��ƽ�������ƶ���
��ƽ�������ƶ���![]() �����ʵ�������CO�����ʵ�����С����Ӧ������ʵ����������������һ�£���ѡd��
�����ʵ�������CO�����ʵ�����С����Ӧ������ʵ����������������һ�£���ѡd��
��a.��λʱ��������3nmol![]() ��ͬʱ����nmolCO��ֻ��������Ӧ���ʣ���Ӧ��һ��ƽ�⣬�ʲ�ѡa��
��ͬʱ����nmolCO��ֻ��������Ӧ���ʣ���Ӧ��һ��ƽ�⣬�ʲ�ѡa��
![]() ��Ӧǰ���������ʵ����DZ�����������ѹǿ���ٱ仯����֪���ʵ������䣬Ϊƽ��״̬����ѡb��
��Ӧǰ���������ʵ����DZ�����������ѹǿ���ٱ仯����֪���ʵ������䣬Ϊƽ��״̬����ѡb��
![]() �����������������䣬��������ܶ�ʼ�ղ��仯���ܶȲ��䲻һ��ƽ�⣬�ʲ�ѡc��
�����������������䣬��������ܶ�ʼ�ղ��仯���ܶȲ��䲻һ��ƽ�⣬�ʲ�ѡc��
![]() ����
���� ����������ƽ����Է��������DZ�������������ƽ����Է����������ٱ仯��һ���ﵽƽ��״̬����ѡd��
����������ƽ����Է��������DZ�������������ƽ����Է����������ٱ仯��һ���ﵽƽ��״̬����ѡd��
e.![]() �������������ٱ仯������ƽ��������������һ��Ϊƽ��״̬����ѡe��
�������������ٱ仯������ƽ��������������һ��Ϊƽ��״̬����ѡe��
��![]() ��
��
![]()
���ݸ�˹���ɿ�֪![]() �õ�
�õ�![]() ���ɱ������ݿ�֪900Kʱ���÷�Ӧ��ƽ�ⳣ��
���ɱ������ݿ�֪900Kʱ���÷�Ӧ��ƽ�ⳣ��![]() ����
����![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������������۲���ȷ��( )
ѡ�� | ʵ�鲽�� | ���� | ���� |
A | �����Ը��������Һ�еμӲ�����Һ | ��Һ��ɫ | ������л�ԭ�� |
B | ��Na2CrO4��Һ�еμӹ���Ũ���� | ��Һ�ɻ�ɫת��Ϊ�Ȼ�ɫ | CrO42-��������������ȫתΪCr2O72- |
C | װ��NO2����ƿ������ˮ�� | ��ƿ����ɫ���� | �����¶ȣ�ƽ��2NO2 |
D | ��Na2S2O3��Һ�еμ�ϡ���� | �е���ɫ�������� | S2O32-��H+���ܹ��� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���F(C21H20O6)���ٴ�ҽѧ�Ͼ���Ԥ�����������ã���ϳ�·�����£����з�Ӧ���з�Ӧ���ԭ��������Ϊ100����
��֪����. ![]()
![]()
![]() +H2O
+H2O
��. ![]()
![]()
![]() +CO2
+CO2
��. ![]() +
+![]()
![]()
![]() +H2O
+H2O
��ش��������⣺
(1) B�к��еĹ�����������____________��
(2)��Ӧ�ٵĻ�ѧ����ʽ��____________�� ��Ӧ�ܵĻ�ѧ����ʽ��____________��
(3) F�Ľṹ��ʽ��____________��
(4) E��ͬ���칹���У�ͬʱ�����������������Ĺ���__________�֣����к˴Ź�����������4�����շ��ͬ���칹��Ľṹ��ʽΪ__________��
�ٱ����ϵ�һȡ����ֻ��2�֣�
��1mol������������NaOH��Һ��Ӧʱ����Ӧ����3molNaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100 mL 0.01 molL��1 HA��Һ����μ���0.02 molL��1��MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯���������˵������ȷ����
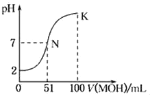
A. HAΪһԪǿ�ᣬMOHΪһԪ����
B. N����Һ������Ũ�ȴ�С��ϵΪ��c��M+��=c��A������c��H+��=c��OH����
C. N��ˮ�ĵ���̶ȴ���K��ˮ�ĵ���̶�
D. N��K֮������������һ�㶼��c��M+�� ��c��OH������c��A������c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У������������ᣨ�ף� Ka=1.8��10-5����һ�����ᣨ�ң� Ka=1.4��10-3����ˮ�еĵ������Ũ�ȹ�ϵ���ǣ���

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̼�IJ�����������ʵ������������ŵ���Ҫ;��֮һ��
��1��Ŀǰ��ҵ���õIJ�̼��NH3��(NH4)2CO3��������CO2�������¿��淴Ӧ��
2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ��H1
(NH4)2CO3(aq) ��H1
NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) ��H2
NH4HCO3(aq) ��H2
(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ��H3
2NH4HCO3(aq) ��H3
����H3=______________���ú���H1����H2�Ĵ���ʽ��ʾ��
��2������CO2�Ʊ���ϩ���ҹ���Դ�����һ����Ҫս�Է��������£�
����һ��CO2������ϳ���ϩ���䷴ӦΪ��
2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ��H=a kJ��mol-1
C2H4(g)+4H2O(g) ��H=a kJ��mol-1
��ʼʱ��n(CO2)��n(H2)=1��3��Ͷ�ϱȳ���20L�ĺ����ܱ������У���ͬ�¶���ƽ��ʱ��H2��H2O�����ʵ�����ͼ����ʾ��


������˵����ȷ����________��
A���÷�Ӧ����Ӧ�Ļ��С���淴Ӧ�Ļ��
B��������������ʱ����ѹ�������ݻ��������Ӱٷ�������v����v��������
C����������ڻ������ƽ������������ʱ��ı�ʱ��˵����Ӧ�Ѵﵽƽ��
D��ʹ�ú��ʵĴ����������ı䷴Ӧ���̣���С��Ӧ�ʱ䣬�ӿ췴Ӧ����
��393K�£�H2��ƽ��ת����Ϊ__________��������λ��Ч���֣���
��393K�£��÷�Ӧ�ﵽƽ������������а�n(CO2)��n(H2)=1��3Ͷ��CO2��H2��n(H2)/n(C2H4)��__________�������䡱��С������ȷ��������
���������ö��Ե缫���ǿ���ԵĶ�����̼ˮ��Һ�ɵõ���ϩ����ԭ����ͼ����ʾ��
��b�缫�ϵĵ缫��ӦʽΪ_________________________��
�ݸ�װ����ʹ�õ���_________________������������������ӽ���Ĥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̫���ܹ����ص��ˮ�ɽ����Ƶøߴ�H2��O2������ʾ��ͼ��ͼ��ʾ������˵��������ǣ� ��
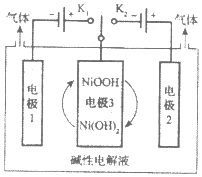
A.��H2ʱ������K1����O2ʱ������K2
B.����H2�ĵ缫��Ӧʽ��2H++2e-=H2��
C.��O2ʱ�缫3�����ĵ缫��ӦΪNiOOH+H2O+e-=Ni��OH��2+OH-
D.ͨ�����ƿ��ؽ�������K1��K2������ʹ�缫3ѭ��ʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���Ϊ��������Դ��Խ��Խ�ܵ����ǵĹ�ע����֪�״��Ʊ����йػ�ѧ��Ӧ��ƽ�ⳣ�����ʱ���������
��ѧ��Ӧ | 500��ƽ�ⳣ�� | �ʱ� |
��CO(g)��2H2(g) | K1��2.5 | ��H1����116 kJ��mol��1 |
��CO2(g)��H2(g) | K2��1.0 | ��H2����41 kJ��mol��1 |
��CO2(g)��3H2(g) | K3���� | ��H3���� |
��1����Ӧ�۵�K3��__����H3��___��
��2�����ڷ�Ӧ�������¶�ƽ�ⳣ��___(�������С�����䡱)��
��3��500��ʱ��÷�Ӧ����ijʱ��CO2(g)��H2(g)��CH3OH(g)��H2O(g)��Ũ��(mol��L��1)�ֱ�Ϊ0.1��0.8��0.3��0.15�����ʱv��__v��(����>����<������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ������������ǣ� ��
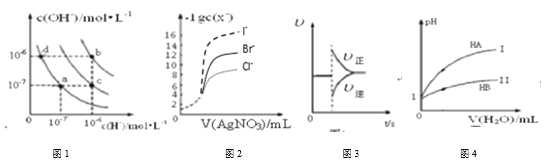
A.ͼ1����b���Ӧ�¶��£���pH��2��H2SO4��Һ��pH��12��NaOH��Һ�������Ϻ���Һ������
B.��0.0100 mol/L����������Һ���ζ�Ũ�Ⱦ�Ϊ0.1000 mol/L Cl����Br����I���Ļ����Һ����ͼ2���ߣ���ȷ�����ȳ�������Cl��
C.ͼ3��ʾ��N2(g)+3H2(g) ![]() 2NH3(g)�ﵽƽ���СNH3Ũ��ʱ���ʵı仯
2NH3(g)�ﵽƽ���СNH3Ũ��ʱ���ʵı仯
D.ͼ4��ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯��������ʵ���Ũ�ȵ�NaA��NaB�����Һ�У�c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com