
【题目】写出下列反应的离子方程式
(1) 用稀硫酸清除铁锈(Fe2O3): _____________
(2) FeCl3溶液中加入NaOH溶液:_____________
科目:高中化学 来源: 题型:
【题目】电解CO(NH2)2(尿素)的碱性溶液制氢气的装置如图所示(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极)。下列说法不正确的是
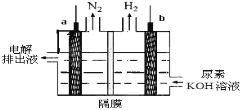
A.电解时,a极发生氧化反应
B.溶液中OH-逐渐向a极移动
C.电解时a极的电极反应式为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
D.若在a极产生标况下224mL N2,则消耗尿素2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中能大量共存的是( )。
A. 无色溶液中:K+、Na+、MnO4-、SO42-
B. 酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
C. 加入Al能放出H2的溶液中:HCO3-、NO3-、Mg2+、Na+
D. pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是从黄花蒿中提取的一种无色针状晶体,双氢青蒿素是青蒿素的重要衍生物,抗疟疾疗效优于青蒿素,请回答下列问题:
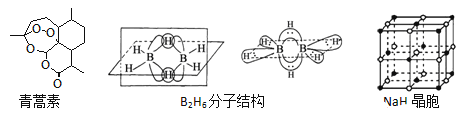
(1)组成青蒿素的三种元素电负性由大到小排序是__________,画出基态O原子的价电子排布图__________。
(2)一个青蒿素分子中含有_______个手性碳原子。
(3)双氢青蒿素的合成一般是用硼氢化钠(NaBH4)还原青蒿素.硼氢化物的合成方法有:
2LiH+B2H6=2LiBH4; 4NaH+BF3═NaBH4+3NaF
①写出BH4﹣的等电子体_________(分子、离子各写一种);
②B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心二电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子.则B2H6分子中有______种共价键,B原子的杂化方式为________ ;
③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是______________;
④NaH的晶胞如图,则NaH晶体中阳离子的配位数是_________;设晶胞中阴、阳离子为刚性球体且恰好相切,求阴、阳离子的半径比![]() =__________。
=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的定容密闭容器中,进行可逆反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④ B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④ B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
A.只有④ B.②③ C.②③④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——物质结构与性质】
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个电子;C的基态原子2p能级有1个电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)写出基态E原子的价电子排布式________。基态A原子的第I电离能比B的大,其原因是____。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是_________。
(3)A的最简单氢化物分子的空间构型为___________,其中A原子的杂化类型是_________。
(4)向E的硫酸盐溶液中通入A的气态氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。
①该蓝色晶体的化学式为_________,加入乙醇的目的是____________。
②写出该配合物中配离子的结构简式___________。
(5)C和D形成的化合物的晶胞结构如图所示,则D的配位数是_______,已知晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,求晶胞边长a=________cm(含用ρ、NA的计算式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. SO2具有氧化性,可用于漂泊纸浆
B. NH4HCO3 受热易分解,可用作氮肥
C. 明矾溶于水产生的SO42- 有氧化性,可用于净水
D. 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 A、B、C、D、E、F 的原子序数依次增大,A 原子核外最外 层电子数是其电子层数的 2 倍,A、B 的核电荷数之比为 3:4。C 与 D 均为金属元素,5.8 g D 的氢氧化物恰好能与 100 mL 2 mol·L-1 盐酸完全反应,D 原子核中质子数和中子数相等。E 与F 相邻,F-的最外层为 8 电子结构。根据上述条件,用化.学.用.语.回答:
(1)D 在周期表中的位置____;
(2)B、C 易形成淡黄色化合物,其电子式为____,该物质含有的化学键 类型为_____;
(3)用电子式表示 DF2 的形成过程____;
(4)元素 E、F 中非金属性较强的是____,请用一个置换反应证明____(写化学反应方程式);
(5)原子半径:C____E;熔点:DB____CF(填“>”“<”或“=”);
(6)A、B、E 可形成一个三原子分子,且每个原子均达到 8 电子稳定结构,则该分子的 结构式为____;含 A元素的化合物在是自然界种类最多的原因是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com