
分析 (1)硅酸盐由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水(xMO•nSiO2•mH2O),氧化铝、二氧化硅与氢氧化钠溶液反应,氧化镁与氢氧化钠溶液不反应;
(2)Al与NaOH溶液反应,而Mg不能,以此除杂;
(3)胃酸的主要成分为盐酸,Al(OH)3是胃舒平的主要成分,盐酸与氢氧化铝反应生成氯化铝和水,据此书写离子方程式;
(4)根据题意利用反应过程中的变化进行分析计算,镁和铝的混合物中加入适量的稀硫酸全部反应生成氢气b L,和氯化镁和氯化铝;向反应后的溶液中加入c mol/L氢氧化钾溶液V mL使金属离子刚好沉淀完全,得到的沉淀为氢氧化镁和氢氧化铝,质量为ng,固体灼烧得到氧化镁和氧化铝质量为pg,结合各步反应进行计算判断.
解答 解:(1)硅酸盐由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水,MgAl2H4Si4O14改写成氧化物形式为MgO•Al2O3•4SiO2•2H2O,
故答案为:MgO•Al2O3•4SiO2•2H2O;
(2)Al与NaOH溶液反应,而Mg不能,选NaOH溶液来除杂,发生离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)胃酸的主要成分为盐酸,Al(OH)3是胃舒平的主要成分,盐酸与氢氧化铝反应生成氯化铝和水,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)反应化学方程式为;Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑;MgSO4+2KOH=Mg(OH)2↓+K2SO4;
Al2(SO4)3+6KOH=2Al(OH)3↓+3K2SO4;Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O;
2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;根据化学方程式可得:
A、根据化学方程式的定量关系,生成的氢气的物质的量等于参加反应的碱的物质的量的一半,即b=22.4L/mol×$\frac{c×v/1000}{2}$,整理得c=$\frac{1000b}{11.2v}$,所以A项正确;
B、选项中p为生成的氧化物的质量,1molMg可结合1molO,2molAl结合3molO,因此生成沉淀的物质的质量等于镁和铝的质量之和加氧元素的质量,而结合氧元素的物质的量等于生成氢气的物质的量,也等于消耗氢氧根离子的物质的量的一半,即p=$\frac{c×v/1000}{2}$+m=m+$\frac{vc}{125}$所以B项正确;
C、得到的氢氧化镁和氢氧化铝的质量等于镁铝的质量和与氢氧根离子的质量之和,即n=m+c×$\frac{v}{1000}$×17=m+$\frac{cv}{1000}$×17,选项中忽略了体积的单位,故C错误;
D、氧化镁和氧化铝的质量可以按照极值方法计算,若mg全是镁,得到的氧化物为氧化镁,根据元素守恒,则质量为P=$\frac{m}{24}$=$\frac{5}{3}$;若mg全是铝,得到的氧化物为氧化铝,根据元素守恒,则质量为p=$\frac{m}{27}$=$\frac{17}{9}$;质量介于二者之间,故D正确;
故选C.
点评 本题知识点多,综合性强,难度大,考查了硅酸盐的表示方法、物质除杂和鉴别、依据化学方程式的计算等,其中(4)是难点,注意根据化学方程式计算的基本方法.


科目:高中化学 来源: 题型:选择题
| A. | 水的电离程度始终增大 | |
| B. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO?) | |
| C. | c(CH3COOH)与c(CH3COO?)之和始终保持不变 | |
| D. | $\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O}$先增大再减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 验证二氧化硫漂白性 | 二氧化硫通入溴水中,看溶液颜色是否褪色 |
| B | 检验氯化铁溶液中是否含FeCl2 | 向氯化铁溶液中滴加氢氧化钠溶液 |
| C | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀粉溶液,观察溶液是否变蓝 |
| D | 验证Ksp(AgI)>Ksp(AgCl) | 向含等物质的量NaCl、KI的混合液中滴加AgNO3溶液,观察沉淀颜色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
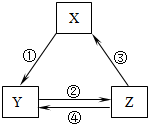 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )| 选项 | X | Y | Z |
| A | CaO | Ca(OH)2 | CaCO3 |
| B | AlCl3 | NaAlO2 | Al(OH)3 |
| C | Fe2O3 | FeCl3 | Fe(OH)3 |
| D | Fe | FeCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫代硫酸钠溶液与稀硫酸混合:S2O32-+2H+═S↓+SO2↑+H2O | |
| B. | 向CuSO4溶液中通入H2S气体:Cu2++S2-═CuS↓ | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S↓+2Cl- | |
| D. | 重铬酸钾的溶液中存在着如下平衡:Cr2O72-(橙红色)+H2O═2H++2CrO42-(黄色) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO42-、CO32-中的一种或几种,取此溶液做下列实验
有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO42-、CO32-中的一种或几种,取此溶液做下列实验查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3H2S+2NO3-+2H+═2NO↑+3S↓+4H2O | |
| B. | 3Fe3++3NO3-+6H2S═3NO↑+6S↓+3Fe2++6H2O | |
| C. | Fe3++3NO3-+5H2S+2H+═3NO↑+5S↓+Fe2++6H2O | |
| D. | Fe3++9NO3-+14H2S+8H+═9NO↑+14S↓+Fe2++18H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com