
| A. | 3H2S+2NO3-+2H+═2NO↑+3S↓+4H2O | |
| B. | 3Fe3++3NO3-+6H2S═3NO↑+6S↓+3Fe2++6H2O | |
| C. | Fe3++3NO3-+5H2S+2H+═3NO↑+5S↓+Fe2++6H2O | |
| D. | Fe3++9NO3-+14H2S+8H+═9NO↑+14S↓+Fe2++18H2O |
分析 酸性溶液中,氧化性HNO3>Fe3+,硫化氢不足,只有硝酸根离子氧化硫化氢;硫化氢足量,则Fe(NO3)3完全反应,若硫化氢部分过量,则硝酸根离子完全反应,铁离子部分反应,以此来解答.
解答 解:A.酸性溶液中,氧化性HNO3>Fe3+,硫化氢不足,硝酸根离子氧化硫化氢,由电子、电荷守恒可知离子反应为:3H2S+2NO3-+2H+=2NO↑+3S↓+4H2O,故A正确;
B.由于氧化性HNO3>Fe3+,溶液中铁离子与硝酸根离子的物质的量之比为1:3,不可能发生反应3Fe3++3NO3-+6H2S═3NO↑+6S↓+3Fe2++6H2O,故B错误;
C.硫化氢足量,则Fe(NO3)3完全反应,由电子、电荷守恒可知离子反应为:Fe3++3NO3-+5H2S+2H+=3NO↑+5S↓+Fe2++6H2O,故C正确;
D.当硝酸根离子部分过量,可能发生反应:Fe3++9NO3-+14H2S+8H+═9NO↑+14S↓+Fe2++18H2O,故D正确;
故选B.
点评 本题考查离子反应的书写,为高频考点,明确发生的化学反应及电子守恒为解答的关键,侧重氧化还原反应的离子反应考查,注意氧化性的强弱及反应的先后顺序,题目难度中等.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液中加入过量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 次氯酸钙溶液中加入亚硫酸钠:SO32-+Ca2+═CaSO3↓ | |
| C. | NH4HCO3溶液中加足量NaOH溶液共热:HCO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的双氧水:2Fe2++2H++H2O2═2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
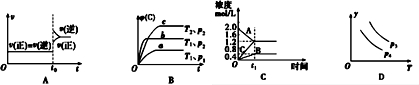
| A. | 对于达到平衡状态的N2(g)+3H2(g)?2NH3 (g)在t0时刻充入了一定量的NH3,平衡逆向移动 | |
| B. | 对于反应 2A(g)+B(g)?C(g)+D(g)△H<0,p2>p1,T1>T2 | |
| C. | 该图象表示的化学方程式为:2A═B+3C | |
| D. | 对于反应 2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Y的百分含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4溶液显强碱性,能消毒杀菌 | |
| B. | Na2FeO4具有强氧化性,能消毒杀菌 | |
| C. | Na2FeO4的氧化产物Fe3+易水解为Fe(OH)3,可以净水 | |
| D. | Na2FeO4的还原产物Fe2+易水解为Fe(OH)2,可以净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子.现分别取溶液进行下列实验:
有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子.现分别取溶液进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的元凶 | |
| B. | 天津港爆炸事件中可知,当电石、钠、氰化钠等物品遇到明火时,应迅速用水浇灭 | |
| C. | 新发现一种固态碳,外形似海绵,密度小,有磁性,其与金刚石的关系是同素异形体 | |
| D. | 热的纯碱溶液去除厨房油污效果比冷的纯碱溶液效果好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com