
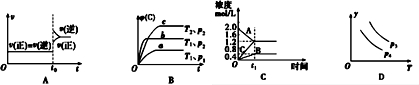
| A. | 对于达到平衡状态的N2(g)+3H2(g)?2NH3 (g)在t0时刻充入了一定量的NH3,平衡逆向移动 | |
| B. | 对于反应 2A(g)+B(g)?C(g)+D(g)△H<0,p2>p1,T1>T2 | |
| C. | 该图象表示的化学方程式为:2A═B+3C | |
| D. | 对于反应 2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Y的百分含量 |
分析 A、对于达到平衡状态的N2(g)+3H2(g)?2NH3 (g)在t0时刻充入了一定量的NH3,c(NH3)立即增大,则V逆立即增大;
B、根据“定一议二”的原则,按照“先拐先平数值大”的规律来分析;
C、此反应最后达平衡,故为可逆反应;
D、从图象可知,温度T升高,y降低.
解答 解:A、对于达到平衡状态的N2(g)+3H2(g)?2NH3 (g)在t0时刻充入了一定量的NH3,c(NH3)立即增大,故V逆立即增大,由于反应物的浓度是在原来基础上逐渐增大,故V正在原来基础上逐渐增大,不会出现突变,故A错误;
B、根据“定一议二”的原则,将曲线a和b做对比可知压强p2>p1,将曲线b和c做对比可知温度T1>T2,故B正确;
C、根据图象可知,A为反应物,B和C为生成物,在t1时反应达平衡,A、B、C的浓度该变量分别为0.8mol/L、0.4mol/L和1.2mol/L,故A、B、C的计量数之比为2:1:3,由于此反应最后达平衡,故为可逆反应,故化学方程式为:2A?B+3C,故C错误;
D、从图象可知,温度T升高,y降低.而对于反应 2X(g)+3Y(g)?2Z(g)△H<0,升高温度,平衡左移,Y的百分含量升高,故y不能表示Y的百分含量,故D错误.
故选B.
点评 本题考查了化学平衡中的图象问题,应会从图象中提取有用的信息来加以加工,难度不大,注意“先拐先平数值大”规律的运用.


 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 用可见光束照射以区别溶液和胶体 | |
| C. | Na2O、Fe2O3、Al2O3都是碱性氧化物 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫代硫酸钠溶液与稀硫酸混合:S2O32-+2H+═S↓+SO2↑+H2O | |
| B. | 向CuSO4溶液中通入H2S气体:Cu2++S2-═CuS↓ | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S↓+2Cl- | |
| D. | 重铬酸钾的溶液中存在着如下平衡:Cr2O72-(橙红色)+H2O═2H++2CrO42-(黄色) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO42-、CO32-中的一种或几种,取此溶液做下列实验
有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO42-、CO32-中的一种或几种,取此溶液做下列实验查看答案和解析>>
科目:高中化学 来源: 题型:解答题
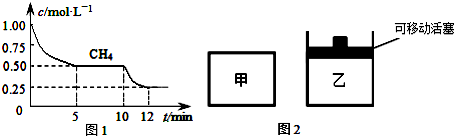
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3H2S+2NO3-+2H+═2NO↑+3S↓+4H2O | |
| B. | 3Fe3++3NO3-+6H2S═3NO↑+6S↓+3Fe2++6H2O | |
| C. | Fe3++3NO3-+5H2S+2H+═3NO↑+5S↓+Fe2++6H2O | |
| D. | Fe3++9NO3-+14H2S+8H+═9NO↑+14S↓+Fe2++18H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| B. | 铁钉放入硫酸铁溶液中:Fe+Fe3+═2Fe2+ | |
| C. | 向AlCl3溶液中加入过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 将稀硫酸滴入氢氧化钡溶液中:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com