
【题目】如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4) ( )
![]()
A.反应前后左室的压强相同
B.开始时左右两室中的分子数相同
C.反应后容器内的密度与反应前的相同
D.反应后容器内无O2存在
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关金属及其合金的说法正确的是
A.在化学反应中,金属失电子,被还原
B.合金与各组分金属相比一般具有更低的熔点
C.生铁、普通钢和不锈钢中的碳含量依次增加
D.Fe2O3是磁铁矿的主要成分,属于碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①亚硝酸钠(NaNO2)是一种食品添加剂,为无色、无气味的同体,具有防腐和抗氧化作用。②AgNO2是一种微溶于水、易溶于酸的浅黄色固体。
I.问题探究
(1)人体正常的血红蛋白中应含Fe2+,误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,出现青紫而中毒,原因是___________。若发生中毒时,你认为下列物质有助于解毒的是____(填字母)。
A.牛奶 B.Mg(OH)2 C.维生素C D.小苏打
(2)由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。要区别NaNO2和NaCl两种固体,你需用的试剂是_______________。
II.实验测定
为了测定某样品中NaNO2的含量,某同学进行如下实验:
①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液VmL。
(1)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有________。
(2)在进行滴定操作时,KMnO4溶液盛装在______(填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,________时达到滴定终点。
(3)滴定过程中发生反应的离子方程式是________;测得该样品中NaNO2的质量分数为_____。
(4)若滴定管未用KMnO4标准溶液润洗就直接注入,则测定结果______(填“偏大”、“偏小”或“无影响”,下同);若滴定过程中刚出现颜色变化就停止滴定,则测定结果________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取MgSO4·7H2O的工艺流程如下:
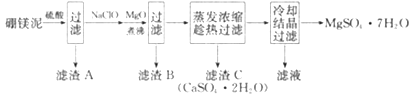
回答下列问题:
(1)Na2B4O7·10H2O中B的化合价为_______;Na2B4O7可制备强还原剂NaBH4,写出NaBH4的电子式:_______。
(2)滤渣A中除含有H3BO3外。还含有_______;加入硫酸时Na2B4O7发生反应的化学方程式为_______。
(3)滤渣B中含有不溶于稀盐酸,但加热时能溶于浓盐酸的黑色固体,写出生成黑色固体的离子方程式:_______;加入MgO的目的是_______。
(4)碱性条件下,阴极上电解NaBO2溶液也可制得硼氢化钠,其电极反应式为_______;“有效氢含量”(即:每克含氢还原剂的还原能力相当于多少克H2的还原能力)可用来衡量含氢还原剂的还原能力,则NaBH4的有效氢含量为_______(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成橙黄色晶体Co(NH3)6Cl3,实验流程和装置图如下:
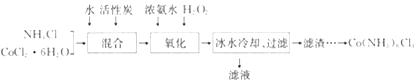
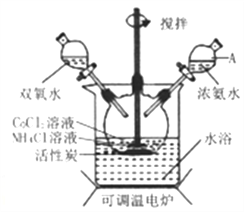
已知:①不同温度下,Co(NH3)6Cl3在水中溶解度曲线如图所示。
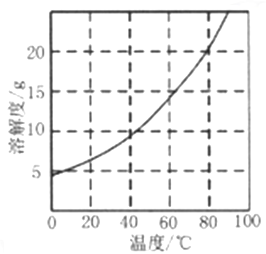
②Co(NH3)6Cl3 在溶液中主要以Co(NH3)63+和Cl- 形式存在,加入少量浓盐酸有利于结晶析出。
③Ksp[Co(OH)2]=1.09×10-15,Ksp[Co(OH)3]=1.6×10-44。
回答下列问题:
(1)图中仪器A的名称是_______;在实验过程中NH4Cl除作反应物外,还可防止在滴加氨水时生成粉红色Co(OH)2沉淀,其原理是_______。
(2)氧化过程在图所示装置中进行,生成Co(NH3)6Cl3。
①氧化时须先加入氨水,再加入H2O的目的是_______;该反应的离子方程式为_______。
②反应时需要控制温度在50~60℃之间,温度不能过高的原因是_______。
(3)冰水冷却的目的是_______ ;滤渣中所含有的主要杂质为_______。
(4)请完成由过滤后所得滤渣获取Co(NH3)6Cl3的实验方案:将滤渣加入沸水中,充分搅拌,趁热过滤,_______,再用少许乙醇洗涤,低温干燥。
(5)上述实验过程中若不使用活性炭作催化剂,则会得到紫红色晶体Co(NH3)5Cl3(M=250.5g·mol-1)。取2.505g紫红色晶体,溶于水后加入足量AgNO3溶液,生成白色沉淀2.870g,写出该反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①H2 ②铝 ③CaO固体 ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦熔融的KNO3 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣=H2O,该离子反应对应的化学方程式为____________________________________。
(2)⑩在水中的电离方程式为___________________________。
(3)以上属于电解质的共有____________种。
(4)将少量的④通入⑥的溶液中反应的离子方程式为___________________________。
(5)配平② 与 ⑨发生反应的化学方程式,并用双线桥法标明该反应中电子转移的方向和数目____Al + ___HNO3 = ___Al(NO3)3 + ___NO↑ +__ ______ ;当有8.1g Al发生反应时,转移电子的物质的量为__________mol,HNO3的作用是酸和氧化剂其物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Mg2+、Ba2+、Cl-、HCO3-中的一种或几种离子。为确定其成分,进行以下实验:
实验1:取10mL无色溶液,滴加适量稀盐酸无明显现象。
实验2:另取10mL无色溶液,加入足量的Na2SO4溶液,有白色沉淀生成。
实验3:将实验1后的溶液于锥形瓶中,向锥形瓶中逐滴加入NaOH溶液,滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如右图所示。

回答下列问题:
(1)原溶液中不存在的离子有__________,存在的离子有________________。检验存在的阴离子的方法是________________________________________
(2)实验3中,图像中OA段反应的离子方程式为____________________________。
(3)根据图像计算原溶液中Mg2+的物质的量浓度_______。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铝在造纸、水净化、土壤改良中有着广泛的应用,同时还是泡沫灭火器中的试剂。某化工厂利用含铝废料(成分为A12O3,SiO2及少量FeO·xFe2O3)制备硫酸铝晶体的工艺流程如下图所示,回答相关问题。
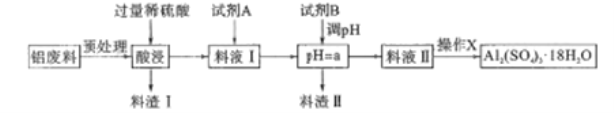
又知生成氢氧化物沉淀的pH如下表:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.6 | 6.3 | 2.3 |
完全沉淀时 | 4.9 | 8.3 | 3.2 |
(1)料渣I的成分是__,操作X的内容是__、洗涤、干燥等。
(2)试剂B最好是__,a的范围是__,由表中数据求出Ksp[Fe(OH)3]<_____(设沉淀完全时金属离子浓度小于1×10-5mol/L)。
(3)试剂A是一种液态绿色氧化剂,料液Ⅰ中反应的离子方程式_______
(4)泡沫灭火器容器构造分为内外两层,内层是玻璃容器、外层是钢筒。则硫酸铝溶液应盛放在______容器中,泡沫灭火器中另一种试剂是小苏打溶液而不是苏打溶液的原因是____.
(5)请设计一种简单的方案,用于确定所制得的晶体组成是否与理论上的组成[Al2(SO4)3·18H2O]相同(写出主要操作过程即可):_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于电解质的叙述中错误的是( )
A.在水溶液中和熔融状态下均不导电的化合物叫非电解质
B.电解质、非电解质都指化合物而言,单质不属于此范畴
C.电解质在水中一定能导电,在水中导电的化合物一定是电解质
D.纯水的导电性很差,但水也是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com