
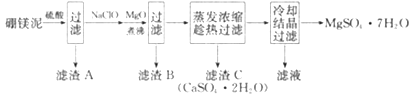
【题目】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取MgSO4·7H2O的工艺流程如下:
回答下列问题:
(1)Na2B4O7·10H2O中B的化合价为_______;Na2B4O7可制备强还原剂NaBH4,写出NaBH4的电子式:_______。
(2)滤渣A中除含有H3BO3外。还含有_______;加入硫酸时Na2B4O7发生反应的化学方程式为_______。
(3)滤渣B中含有不溶于稀盐酸,但加热时能溶于浓盐酸的黑色固体,写出生成黑色固体的离子方程式:_______;加入MgO的目的是_______。
(4)碱性条件下,阴极上电解NaBO2溶液也可制得硼氢化钠,其电极反应式为_______;“有效氢含量”(即:每克含氢还原剂的还原能力相当于多少克H2的还原能力)可用来衡量含氢还原剂的还原能力,则NaBH4的有效氢含量为_______(保留2位有效数字)。
【答案】 +3 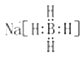 SiO2 Na2B4O7+H2SO4+5H2O=Na2SO4+H3BO3↓ ClO-+Mn2++H2O=MnO2↓+Cl-+2H+ 调节溶液的pH,使Fe3+转化为氢氧化铁沉淀除去 BO2-+6H2O+8e-=BH4-+8OH- 0.21
SiO2 Na2B4O7+H2SO4+5H2O=Na2SO4+H3BO3↓ ClO-+Mn2++H2O=MnO2↓+Cl-+2H+ 调节溶液的pH,使Fe3+转化为氢氧化铁沉淀除去 BO2-+6H2O+8e-=BH4-+8OH- 0.21
【解析】试题分析:由题中信息可知,硼镁泥经硫酸浸取后过滤除去滤渣A,滤渣A主要含H3BO3和SiO2,滤液中主要含硫酸镁、硫酸亚铁、硫酸铁、硫酸锰、硫酸钙等等;滤液中加入次氯酸钠把亚铁离子氧化为铁离子、把锰离子氧化为二氧化锰,过滤除去滤渣B,滤渣B主要为二氧化锰;滤液以蒸发浓缩、趁热过滤,除去滤渣C(石膏),滤液以冷却结晶、过滤,即得到MgSO4·7H2O。
(1)Na2B4O7·10H2O中Na、H、O的化合价分别为+1、+1、-2,故B的化合价为+3; NaBH4为离子化合物,其由钠离子和硼氢根离子组成,其电子式为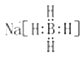 。
。
(2)滤渣A中除含有H3BO3外。还含有SiO2;加入硫酸时Na2B4O7发生反应的化学方程式为Na2B4O7+H2SO4+5H2O=Na2SO4+H3BO3↓。
(3)滤渣B中含有不溶于稀盐酸,但加热时能溶于浓盐酸的黑色固体,则此黑色固体是MnO2,生成黑色固体的离子方程式为ClO-+Mn2++H2O=MnO2↓+Cl-+2H+;加入MgO的目的是调节溶液的pH,使Fe3+水解转化为氢氧化铁沉淀除去。
(4)碱性条件下,阴极上电解NaBO2溶液也可制得硼氢化钠,其电极反应式为BO2-+6H2O+8e-=BH4-+8OH-;NaBH4作为还原剂时,其中H由-1价降低至+1,故1mol NaBH4可以失去8mol电子,相当于4mol H2的还原能力,故NaBH4的有效氢含量为![]() 0.21。
0.21。


科目:高中化学 来源: 题型:
【题目】若以E(nl)表示某能级的能量,以下各式中正确的是( )
A. E(3s)>E(2s)>E(1s) B. E(3s)>E(3p)>E(3d)
C. E(4f)>E(4s)>E(3d) D. E(5s)>E(4s)>E(4f)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于共价键的说法,正确的是
A.分子内部一定会存在共价键
B.由非金属元素组成的化合物内部一定全是共价键
C.非极性键只存在于双原子单质分子中
D.离子化合物的内部可能存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表叙述不正确的是
A.短周期为第1、2、3周期
B.ⅠA族都是金属元素
C.元素周期表中有7个主族
D.可根据元素在周期表中位置预测其性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因瓦合金是铁和镍的合金,由于其膨胀系数极小,又称不变合金,适合做测量元件。回答下列问题:
(1)基态镍原子的价电子轨道表达式为_______;铁的基态原子核外未成对电子数为_______个。
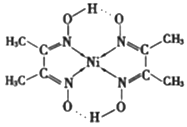
(2)在稀氨水介质中,Ni2+与丁二酮肟(分子式为C4H8N2O2)反应可生成鲜红色沉淀,其分子结构如下图所示,该结构中碳原子的杂化方式为_______;已知丁二酮肟分子结构中C-C键与N-O键的键长和键能数据如下表所示,请从原子结构角度解释N-O键的键能小于C-C键:_______。
化学键 | 键长 (10-12m) | 键能 (kJ/mol) |
C-C | 154 | 332 |
N-O | 146 | 230 |
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、N(CO)4。1个Fe(CO)5分子中含有σ键数目为_______;已知Ni(CO)4分子为正四面体构型,下列溶剂能够溶解Ni(CO)4的是_______(填写字母)。
A.四氯化碳 B.苯 C.水 D.液氨
(4)镍晶胞为面心立方,其中镍原子的配位数为_______。氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的原因是_______。
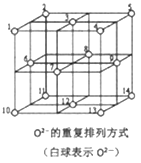
(5)Fe3O4晶体中,O2-的重复排列方式如右图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_______。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_______cm(写出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4) ( )
![]()
A.反应前后左室的压强相同
B.开始时左右两室中的分子数相同
C.反应后容器内的密度与反应前的相同
D.反应后容器内无O2存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中还原剂是___________________(填化学式),被2 mol FeSO4还原的过氧化钠为_________mol
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:__________________________
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________,被氧化的离子的物质的量分别是_____________________________________________
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+被氧化时,c为_____________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质的叙述正确的是( )
A.导电性很强的物质
B.在溶于水或熔融状态下能导电的化合物
C.在溶于水和熔融状态下均电离的化合物
D.可溶性盐类
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com