
【题目】表示下列反应的离子方程式正确的是( )
A.磁性氧化铁溶于稀硝酸: ![]()
B.用浓盐酸与MnO2反应制取少量氯气: ![]()
C.向NaAlO2溶液中通入过量CO2制![]()
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:![]()
【答案】C
【解析】
A、磁性氧化铁溶于稀硝酸,硝酸具有氧化性,能够将亚铁离子氧化成铁离子,反应的离子方程式为:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O,故A错误;
B、用浓盐酸与MnO2反应制取少量氯气的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故B错误;
Mn2++Cl2↑+2H2O,故B错误;
C、向NaAlO2溶液中通入过量CO2制Al(OH)3,离子方程式:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,故C正确;
D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4,正确的离子方程式为:3ClO-+4OH-+2Fe(OH)3═2FeO42-+3Cl-+5H2O,故D错误。
答案选C。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】化合物M是某合成农药的中间体,其结构为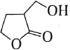 。下列有关的说法正确的是( )
。下列有关的说法正确的是( )
A.M能发生取代反应和加成反应
B.1molM与足量的NaOH溶液反应,最多可消耗2molNaOH
C.分子中有5个碳原子共平面
D.同时含有-CHO和-COOH结构的M的同分异构体有5种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《自然》杂志于2018年3月15日发布,中国留学生曹原用石墨烯实现了常温超导。这一发现将在很多领域发生颠覆性的革命。镓(Ga)、硒(Se)的单质及某些化合物如砷化镓等都是常用的半导体材料,超导和半导体材料都广泛应用于航空航天测控、光纤通讯等领域。请回答下列与碳、砷、镓、硒有关的问题。
(1)基态硒原子的核外价层电子排布式为___,与硒同周期的p区元素中第一电离能大于硒的元素有___种,SeO3的空间构型是___。
(2)化合物[EMIM][AlCl4]具有很高的应用价值,EMIM+结构如图所示。
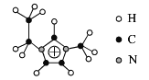
①EMIM+离子中各元素电负性由大到小的顺序是___。
②EMIM+离子中碳原子的杂化轨道类型为___。
③大π键可用符号π![]() 表示,其中m、n分别代表参与形成大π键的原子数和电子数,则EMIM+离子中的大π键应表示___。
表示,其中m、n分别代表参与形成大π键的原子数和电子数,则EMIM+离子中的大π键应表示___。
(3)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯如图所示,转化后1号C原子与相邻C原子间键能变小,原因是___。
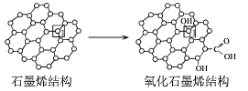
(4)GaAs为原子晶体,密度为ρgcm-3,其晶胞结构如图所示,Ga和As的原子半径分别为apm和bpm,GaAs晶胞中原子的体积占晶胞体积的百分率为A,则阿伏加德罗常数的值为NA=___。(用字母表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.Cl2 +H2O![]() HCl+HClO光照新制的氯水时,颜色变浅,溶液的酸性增强
HCl+HClO光照新制的氯水时,颜色变浅,溶液的酸性增强
B.CO2(aq)![]() CO2(g)打开可乐瓶,有大量气泡从溶液中冒出
CO2(g)打开可乐瓶,有大量气泡从溶液中冒出
C.I2(g)+H2(g) ![]() 2HI(g)的平衡体系,加压后颜色变深
2HI(g)的平衡体系,加压后颜色变深
D.2NO2(g)![]() N2O4(aq)加压后颜色先变深后变浅
N2O4(aq)加压后颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=1048.9 kJ·mol-1
A.ΔH4﹦2ΔH32ΔH2ΔH1
B.O2(g)+2H2(g)![]() 2H2O(l) ΔH5,ΔH5>ΔH3
2H2O(l) ΔH5,ΔH5>ΔH3
C.1 mol O2(g)和 2 mol H2(g)具有的总能量高于 2 mol H2O(g)
D.联氨和 N2O4 作火箭推进剂的原因之一是反应放出大量的热且产物无污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是几种常见的化学电源示意图,有关说法不正确的是
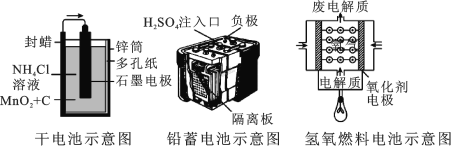
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒变软
C.铅蓄电池工作过程中,每通过 2 mol 电子,负极质量减轻 207 g
D.碱性氢氧燃料电池负极反应式为:H2-2e-+2OH- = 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的 KCl 饱和溶液)
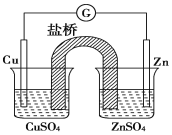
A.正极反应为 Zn- 2e- == Zn2+
B.取出盐桥后,检流计依然发生偏转
C.反应中,盐桥中的 K+会移向 CuSO4 溶液
D.电子从负极流向正极,再经盐桥流回负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作及装置正确的是
A.配制一定物质的量浓度的 NaOH溶液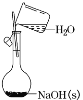
B.比较 NaHCO3和 Na2 CO3 的热稳定性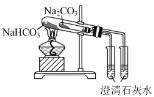
C.制取并观察 Fe(OH)2沉淀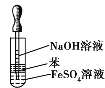
D.蒸馏海水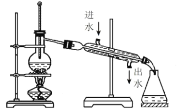
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画出)的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是( )

A.在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存
B.已知在25℃,CO32-的水解平衡常数Kh1=2×10-4,当溶液的pH=10时,溶液中c(HCO3-):c(CO32-)=2:1
C.pH=7时溶液中各种离子其物质的量浓度的大小关系是c(Na+)>c(HCO3-)>c(Cl-)>c(H+)=c(OH-)>c(CO32-)
D.当混合液pH≈6时,开始放出CO2气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com