
【题目】下列实验操作及装置正确的是
A.配制一定物质的量浓度的 NaOH溶液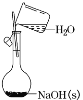
B.比较 NaHCO3和 Na2 CO3 的热稳定性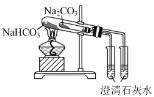
C.制取并观察 Fe(OH)2沉淀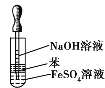
D.蒸馏海水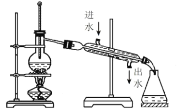
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】为探究氯水中含有的粒子及其性质,某化学小组做了如下实验:
(1)观察氯水颜色,发现氯水呈浅黄绿色,证明氯水中含有的粒子是____(填粒子符号)。
(2)向氯水中滴入Na2CO3溶液,有气体生成,说明氯水中含有的粒子是___(填粒子符号)。
(3)氯水经光照后,观察到的现象是_______,溶液的酸性_____(填“增强”“不变”或“减弱”)。
(4)氯水中具有氧化性的含氯微粒有_______(填粒子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式正确的是( )
A.磁性氧化铁溶于稀硝酸: ![]()
B.用浓盐酸与MnO2反应制取少量氯气: ![]()
C.向NaAlO2溶液中通入过量CO2制![]()
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMn![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[ KAl(SO4)2·12H2O ]在造纸、净水等方面应用广泛。以处理过的废旧易拉罐碎屑为原料(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。
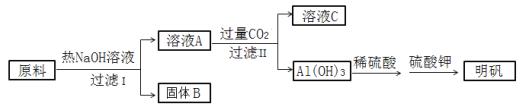
回答下列问题:
(1)KAl(SO4)2的电离方程式______________________________。
(2)原料溶解过程中反应的离子方程式是___________________________________。
(3)明矾溶液与过量的Ba(OH)2溶液反应的离子方程式是______________________________。
(4)溶液A中通入过量CO2,反应的化学方程式是_____________________________________。
(5)为证明固体B中含有铁,某同学做如下实验:取少量固体B,加入稀硫酸使其溶解,观察到有无色气体生成。向溶液中加入__________和__________,溶液立即变红,证明固体B中含有铁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018 年 5 月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:

下列说法正确的是
A.图中能量转化方式只有 2 种
B.b 极发生的电极反应为:N2+6H++6e-= 2NH3
C.H+向 a 极区移动
D.a 极上每产生 22.4L O2 流过电极的电子数为 2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜主要含有LiCoO2、A1等,处理该废料的一种工艺如下图所示:

回答下列问题:
(l) Li的原子结构示意图为____,LiCoO2中Co的化合价是____。
(2)“碱浸”时Al溶解的离子方程式为________。
(3)“酸溶”时加入H2O2的目的是____,调节pH后所得滤渣主要为____。
(4)“沉钴”的离子方程式为________。
(5)配制100mL l.0mol/L (NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外,还需要____。
(6)取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g,则该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸普鲁卡因 (  ) 是一种良好的局部麻醉药, 具有毒性小, 无成瘾性等特点。其合成路线如下图所示:
) 是一种良好的局部麻醉药, 具有毒性小, 无成瘾性等特点。其合成路线如下图所示:

回答下列问题:
(1) 3molA可以合成1molB, 且B是平面正六边形结构, 则B的结构简式为_________。
(2) 有机物C的名称为____________, B→C的反应类型为_____________。
(3) 反应C→D的化学方程式为________________________________________。
(4) F和E发生酯化反应生成G, 则F的结构简式为___________________。
(5) H的分子式为____。
(6) 分子式为C9H12且是C的同系物的同分异构体共有__________种。
(7) 请结合上述流程信息, 设计由苯、 乙炔为原料合成 的路线_______________ 。(其他无机试剂任选)
的路线_______________ 。(其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置如图所示。回答下列问题:
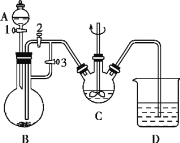
(1)C仪器的名称是___,FeCO3在其中生成,该装置中发生的主要反应的离子方程式为___。
(2)实验时首先打开活塞3,关闭活塞2,再打开活塞1向B中滴加盐酸,其目的是___,关闭活塞1,一段时间后,再关闭活塞___打开活塞__,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中。
Ⅱ.乳酸亚铁晶体((CH3CH(OH)COO)2Fe·3H2O,Mr =288g/mol)是常用的补铁剂。乳酸亚铁可由乳酸与碳酸亚铁反应制得。
(3)将制得的FeCO3加入乳酸溶液中,再加入过量铁粉,75℃下搅拌使之充分反应,结束后,无需过滤,除去过量铁粉的反应方程式为2CH3CH(OH)COOH+Fe=(CH3CH(OH)COO)2Fe+H2↑;从上述所得溶液中获得乳酸亚铁晶体的方法是____、过滤、洗涤、干燥。
(4)该兴趣小组用KMnO4测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数。发现产品的质量分数总是大于100%,其原因可能是___。
经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1的Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2标准溶液19.70mL。滴定反应为Ce4++Fe2+=Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com