
【题目】联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=1048.9 kJ·mol-1
A.ΔH4﹦2ΔH32ΔH2ΔH1
B.O2(g)+2H2(g)![]() 2H2O(l) ΔH5,ΔH5>ΔH3
2H2O(l) ΔH5,ΔH5>ΔH3
C.1 mol O2(g)和 2 mol H2(g)具有的总能量高于 2 mol H2O(g)
D.联氨和 N2O4 作火箭推进剂的原因之一是反应放出大量的热且产物无污染
【答案】B
【解析】
A. ①2O2(g)+N2(g)=N2O4(l)△H1,②N2(g)+2H2(g)=N2H4(l)△H2,③O2(g)+2H2(g)=2H2O(g)△H3
盖斯定律计算2×③2×②①得到④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H4=2△H32△H2△H1,故A正确;
B. O2(g)+2H2(g)=2H2O(g)△H3,O2(g)+2H2(g)=2H2O(l)△H5,气态水变化为液态水过程中放出热量,焓变为负值,则△H5<△H3,故B错误;
C. O2(g)+2H2(g)=2H2O(g)反应为放热反应,△H3<0,反应物的总能量高于生成物的总能量,1molO2(g)和2molH2(g)具有的总能量高于2molH2O(g),故C正确;
D.根据 2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)ΔH4=1048.9 kJ·mol-1分析可知,反应放出大量热,生成氮气和水蒸气无污染气体,联氨和 N2O4 作火箭推进剂的原因之一是反应放出大量的热且产物无污染,故D正确;
答案选B。


 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】某同学设计了下图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱。供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
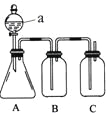
(1)仪器a的名称:________。
(2)锥形瓶中装有某可溶性正盐,a中所盛试剂为________。
(3)装置B所盛试剂是____________________,其作用是_____________。
(4)装置C所盛试剂是_______________,
C中反应的离子方程式是________________。
(5)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题:
(1)已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H1=-akJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H2=-bkJ/mol
H2O(l)=H2O(g) △H3=+ckJ/mol
则NH3(g)在氧气中燃烧生成氮气和液态水的热化学方程式为___。
(2)在合成工氨业中,氮气在催化剂Fe上的吸附分解反应活化能高、速率慢,因此氮气的反应速率决定了合成氨的反应速率。工业生产中,控制温度773K,压强3.0×105pa,原料中n(N2):n(H2)=1:2.8。请分析说明原料气中N2过量的理由___。
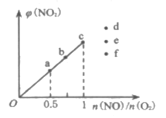
(3)已知反应2NO(g)+O2(g)![]() 2NO2(g),在恒温、恒容的密闭容器中按一定比例充入总物质的量一定的NO(g)和O2(g),平衡时NO2的体积分数[φ(NO2)]随
2NO2(g),在恒温、恒容的密闭容器中按一定比例充入总物质的量一定的NO(g)和O2(g),平衡时NO2的体积分数[φ(NO2)]随![]() 的变化如图所示。NO的转化率最小的是___点(填“a”、“b”、“c”);当
的变化如图所示。NO的转化率最小的是___点(填“a”、“b”、“c”);当![]() =1.5时,达到平衡状态时NO2的体积分数可能是___点(填“d”、“e”、“f”)。
=1.5时,达到平衡状态时NO2的体积分数可能是___点(填“d”、“e”、“f”)。
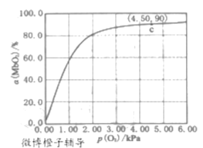
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,反应原理可表示为:Mb(aq)+O2(g)![]() MbO2(aq),该反应的平衡常数可表示为:K=
MbO2(aq),该反应的平衡常数可表示为:K=![]() 。37℃达到平衡时,测得肌红蛋白的结合度(a)与氧气分压[p(O2)]的关系如图所示[α=
。37℃达到平衡时,测得肌红蛋白的结合度(a)与氧气分压[p(O2)]的关系如图所示[α=![]() ×100%]。研究表明正反应速率v正=k正c(Mb)p(O2),逆反应速率v逆=k逆c(MbO2)(其中k正和k逆分别表示正、逆反应的速率常数).
×100%]。研究表明正反应速率v正=k正c(Mb)p(O2),逆反应速率v逆=k逆c(MbO2)(其中k正和k逆分别表示正、逆反应的速率常数).
①α(MbO2),先随p(O2)增大而增大,后来几乎不变,原因是___。
②试写出平衡常数K与速率常数k正、k逆之间的关系式K=___(用含有k正、k逆的式子表示)
③试求出图中c点时,上述反应的平衡常数K=___kPa-1。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.3.9 g Na2O2所含的离子数为0.15 NA
B.标准状况下,每有22.4 L Cl2溶于水,所得溶液中H+的数目为NA
C.20 g 氖气中所含分子的数目为0.5 NA
D.0.2 mol CO2与足量的 Na2O2充分反应,转移的电子总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种芳香酯类物质,也是一种重要的香料,工业上合成它的一种方法如下图所示。图中D的相对分子质量为106,D、E的核磁共振氢谱均只有两个峰,B经过氧化可以得到C。

已知:![]() R1CHO+HCOOH+R2CHO(R1、R2是烃基或者氢原子)。
R1CHO+HCOOH+R2CHO(R1、R2是烃基或者氢原子)。
(1)A的结构简式为___________________________,D的名称是___________________。
(2)D→E的反应类型为_______________,“一定条件”的内容是__________________。
(3)B中官能团的名称是__________,G的结构简式为___________________________。
(4)E→F的化学方程式为_________________。
(5)符合下列条件的F的同分异构体共有________种,写出一种核磁共振氢谱有5个峰的同分异构体的结构简式:________________________________。
①遇FeCl3溶液能发生显色反应 ②含有醚键
(6)写出以乙烯为原料合成HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式正确的是( )
A.磁性氧化铁溶于稀硝酸: ![]()
B.用浓盐酸与MnO2反应制取少量氯气: ![]()
C.向NaAlO2溶液中通入过量CO2制![]()
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
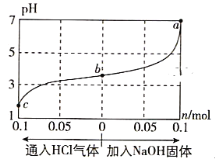
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[ KAl(SO4)2·12H2O ]在造纸、净水等方面应用广泛。以处理过的废旧易拉罐碎屑为原料(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。
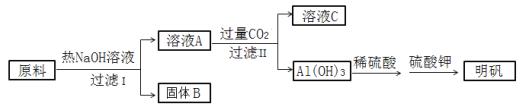
回答下列问题:
(1)KAl(SO4)2的电离方程式______________________________。
(2)原料溶解过程中反应的离子方程式是___________________________________。
(3)明矾溶液与过量的Ba(OH)2溶液反应的离子方程式是______________________________。
(4)溶液A中通入过量CO2,反应的化学方程式是_____________________________________。
(5)为证明固体B中含有铁,某同学做如下实验:取少量固体B,加入稀硫酸使其溶解,观察到有无色气体生成。向溶液中加入__________和__________,溶液立即变红,证明固体B中含有铁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用O2氧化NH3制备硝酸的装置如图所示(夹持装置略),下列说法不正确的是

A.球形干燥管B中可以填充碱石灰或五氧化二磷
B.实验过程中,若熄灭酒精灯,装置C中的氧化铬继续保持红热,说明装置C中的反应放热
C.球形干燥管D中的无水氯化钙可吸收尾气中的氨气和水蒸气
D.装置E中的石蕊试液最终变红,说明锥形瓶中有硝酸产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com