
����Ŀ������������Ի���������������������Ⱦ��кܴ��Ӱ�졣�밴Ҫ��ش��������⣺
��1����֪��4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ��H1=-akJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H2=-bkJ/mol
H2O(l)=H2O(g) ��H3=+ckJ/mol
��NH3(g)��������ȼ�����ɵ�����Һ̬ˮ���Ȼ�ѧ����ʽΪ___��
��2���ںϳɹ���ҵ�У������ڴ���Fe�ϵ������ֽⷴӦ��ܸߡ�����������˵����ķ�Ӧ���ʾ����˺ϳɰ��ķ�Ӧ���ʡ���ҵ�����У������¶�773K��ѹǿ3.0��105pa��ԭ����n(N2)��n(H2)=1��2.8�������˵��ԭ������N2����������___��
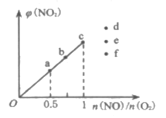
��3����֪��Ӧ2NO(g)+O2(g)![]() 2NO2(g)���ں��¡����ݵ��ܱ������а�һ���������������ʵ���һ����NO(g)��O2(g)��ƽ��ʱNO2���������[��(NO2)]��
2NO2(g)���ں��¡����ݵ��ܱ������а�һ���������������ʵ���һ����NO(g)��O2(g)��ƽ��ʱNO2���������[��(NO2)]��![]() �ı仯��ͼ��ʾ��NO��ת������С����___�㣨����a������b������c��)����
�ı仯��ͼ��ʾ��NO��ת������С����___�㣨����a������b������c��)����![]() =1.5ʱ���ﵽƽ��״̬ʱNO2���������������___�㣨����d������e������f��)��
=1.5ʱ���ﵽƽ��״̬ʱNO2���������������___�㣨����d������e������f��)��
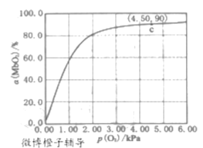
��4�������еļ��쵰��(Mb)��O2�������MbO2����Ӧԭ���ɱ�ʾΪ��Mb(aq)+O2(g)![]() MbO2(aq)���÷�Ӧ��ƽ�ⳣ���ɱ�ʾΪ��K=
MbO2(aq)���÷�Ӧ��ƽ�ⳣ���ɱ�ʾΪ��K=![]() ��37��ﵽƽ��ʱ����ü��쵰�Ľ�϶�(a)��������ѹ[p(O2)]�Ĺ�ϵ��ͼ��ʾ[��=
��37��ﵽƽ��ʱ����ü��쵰�Ľ�϶�(a)��������ѹ[p(O2)]�Ĺ�ϵ��ͼ��ʾ[��=![]() ��100%]���о���������Ӧ����v��=k��c(Mb)p(O2)���淴Ӧ����v��=k��c(MbO2)������k����k���ֱ��ʾ�����淴Ӧ�����ʳ�������
��100%]���о���������Ӧ����v��=k��c(Mb)p(O2)���淴Ӧ����v��=k��c(MbO2)������k����k���ֱ��ʾ�����淴Ӧ�����ʳ�������
����(MbO2)������p(O2)������������������䣬ԭ����___��
����д��ƽ�ⳣ��K�����ʳ���k����k��֮��Ĺ�ϵʽK=___(�ú���k����k����ʽ�ӱ�ʾ)
�������ͼ��c��ʱ��������Ӧ��ƽ�ⳣ��K=___kPa-1��
.
���𰸡�4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ��H=-![]() (2a+3b+30c)kJ/mol N2�������ã�����N2���������������ת���ʣ�������Ӧ��������N2�������ͷֽ����ʾ����ģ�N2�ı�������Ӧ���ʼӿ� c d ǰһ����p(O2)����Ӧ���ʼӿ죬��(MbO2)��֮����μ��쵰��(Mb)����ȫ��ת��ΪMbO2
(2a+3b+30c)kJ/mol N2�������ã�����N2���������������ת���ʣ�������Ӧ��������N2�������ͷֽ����ʾ����ģ�N2�ı�������Ӧ���ʼӿ� c d ǰһ����p(O2)����Ӧ���ʼӿ죬��(MbO2)��֮����μ��쵰��(Mb)����ȫ��ת��ΪMbO2 ![]() 2
2
��������
��1�����ݸ�˹���ɣ�����֪�������Ȼ�ѧ����ʽ���ӣ��͵õ���Ӧ�ķ�Ӧ���Ȼ�ѧ����ʽ��
��2������N2�������������˷�Ӧ��Ũ�ȣ��ܼӿ췴Ӧ���ʣ����������ת���ʣ�
��3����![]() �ı�ֵԽ��NO��ת����ԽС��
�ı�ֵԽ��NO��ת����ԽС��![]() ��ֵԽ��NO2�������������
��ֵԽ��NO2�������������
��4���ٿ�ʼʱp(O2)����Ӧ���ʼӿ죬��(MbO2)��֮���������쵰��(Mb)����ȫ��ת��ΪMbO2����(MbO2)�������䣻
�ڸ��ݿ��淴Ӧ�ﵽƽ��״̬ʱ��V��=V�������ƽ�ⳣ������ʽ����K��k����k���Ĺ�ϵ��
�۽�P(O2)=4.5kPa�����쵰�Ľ�϶�(��)��90%��ͨ���������ƽ�ⳣ������ʽ�ɵ�K��
��1����4NH3(g)+6NO(g) =5N2(g)+6H2O(g) ��H1=��a kJ/mol
��4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) ��H2=��b kJ/mol
��H2O(l)=H2O(g) ��H3=+c kJ/mol
���ݸ�˹���ɣ���(����2+����3-����30)��![]() �������ɵ�4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ��H=-
�������ɵ�4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ��H=-![]() (2a+3b+30c)kJ/mol��
(2a+3b+30c)kJ/mol��
��2���ϳɰ���Ӧ�У�������Fe�ϵ������ֽⷴӦ��ܸߡ������������������ϳɰ��ķ�Ӧ���ʣ����ԭ�����е����������ɼӿ�ϳɰ��ķ�Ӧ���ʣ�ͬʱ�������ת���ʣ��ҵ������Բ��÷���Һ̬�����������õ������Դ�Ϊ��N2�������ã�����N2���������������ת���ʣ�������Ӧ��������N2�������ͷֽ����ʾ����ģ�N2�ı�������Ӧ���ʼӿ졣
��3��![]() �ı�ֵԽ������Ϊ������������������һ��������������NO��ת���ʷ�����С������NO��ת������С����c�㣻��
�ı�ֵԽ������Ϊ������������������һ��������������NO��ת���ʷ�����С������NO��ת������С����c�㣻��![]() =1.5ʱ������ͼʾ��
=1.5ʱ������ͼʾ��![]() ��ֵԽ��NO2����������������Դﵽƽ��״̬ʱ��NO2���������������d�㣻
��ֵԽ��NO2����������������Դﵽƽ��״̬ʱ��NO2���������������d�㣻
��4���ٿ�ʼʱp(O2)�����൱������ѹǿ����������Ũ�ȣ���Ӧ���ʼӿ죬��(MbO2)��֮���������쵰��(Mb)����ȫ��ת��ΪMbO2��p(O2)�����¼���û������MbO2����(MbO2)�������䣬��ԭ���ǣ�ǰһ����p(O2)����Ӧ���ʼӿ죬��(MbO2)��֮����μ��쵰��(Mb)����ȫ��ת��ΪMbO2��
�ڿ��淴Ӧ�ﵽƽ��״̬ʱ��V��=V������������=k����c(Mb)�� P(O2)������=k����c(MbO2)������k����c(Mb)�� P(O2)= k����c(MbO2)��![]() ������ӦMb(ag)+O2(g)
������ӦMb(ag)+O2(g)![]() MbO2(aq)��ƽ�ⳣ��K=
MbO2(aq)��ƽ�ⳣ��K=![]() ��
��
��c��ʱ��P(O2)=4.5�����쵰�Ľ�϶�(��)��90%�����迪ʼʱ��Mb 1mol/L��������=![]() ��100%�������ɵ�MbO20.9mol/L������ƽ�ⳣ������ʽ�пɵ�K=
��100%�������ɵ�MbO20.9mol/L������ƽ�ⳣ������ʽ�пɵ�K=![]() =2 kPa-1��
=2 kPa-1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)������������ȷ����
4NO(g)+6H2O(g)������������ȷ����
A.�ﵽ��ѧƽ��ʱ��4v��(O2) = 5v��(NO)
B.����λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽƽ��״̬
C.�ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ�С���淴Ӧ��������
D.��ѧ��Ӧ���ʹ�ϵ�ǣ�2v��(NH3) = 3v��(H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ĩ״����A���ɵ����ʵ�����MgO��Fe2O3��ɵĻ�����������ʵ�飺
��ȡ����A�������ȷ�Ӧ���������е���B���ɡ�(��ʾ�����������������ķ�Ӧ��Ϊ���ȷ�Ӧ)
����ȡ20g Aȫ������0.15L 6.0mol��L��1�����У�����ҺC��
�۽����еõ��ĵ���B����ҺC��Ӧ���ų�����1.12L(��״����)��ͬʱ������ҺD������������B��
����KSCN��Һ����ʱ����ҺD����ɫ��
(1)��Ӧ�ٵIJ����еĵ���B��________����Ӧ����Ϊ____________����������B���������У�����������Һ�еμ�������NaOH��Һ�����ɿ���������Ϊ___________���˹����û�ѧ���̿��Ա�ʾΪ______________��
(2)������������Ӧ�����ӷ���ʽ�ǣ�___________________��___________________��
(3)����ҺD�������Ϊ0.15L�������Һ��c(Mg2��)Ϊ________��c(Fe2��)Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ֳƹ�ʯ�����Ʊ��輰���軯�������Ҫԭ�ϡ�����ת��������ͼ��ʾ������˵����ȷ����
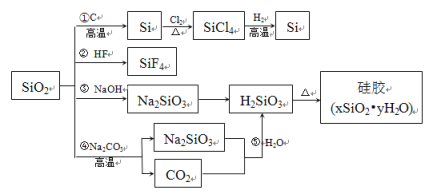
A.SiO2���ܷ����ڷ�Ӧ�����ܷ����۷�Ӧ��˵��SiO2��������������
B.�ܷ�Ӧ��ˮ�ҵ�Ļ�ѧ��Ӧԭ��֮һ���ݷ�Ӧ��֤��H2CO3����ǿ��H2SiO3
C.�ٷ�Ӧ���������Si���CO2���轺����������������
D.���˴ֹ���Ʊ����ᴿ�������漰�ķ�Ӧ�⣬ͼ����ʾ������Ӧ���Ƿ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ý����ƺͿ����Ʊ����Ƚϸߵ�Na2O2�������õ�װ�����£�
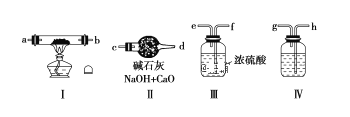
��ش��������⣺
��1�����涨�������������Ϊ�����ң������ʵ��װ��ʱ������������˳���ǣ�
����������____��___��____���������������������������ظ�ʹ�ã���
��2��װ������ʢ�ŵ�ҩƷ��____����������_______��
��3��װ������������______��
��4��������ͨ�����ͼ��ȵ��Ⱥ�˳��Ϊ________��
��5����ȥ��װ�â�װ�â��г���Ӧ����Na2O2�⣬�����ܷ����ķ�Ӧ��______��д��������ѧ����ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ȼ����־��2018��3��15�շ������й���ѧ����ԭ��ʯīϩʵ���˳��³�������һ���ֽ��ںܶ��������߸��Եĸ�������(Ga)����(Se)�ĵ��ʼ�ijЩ���������黯�صȶ��dz��õİ뵼����ϣ������Ͱ뵼����϶��㷺Ӧ���ں��պ����ء�����ͨѶ��������ش�������̼���顢�ء����йص����⡣
(1)��̬��ԭ�ӵĺ���۲�����Ų�ʽΪ___������ͬ���ڵ�p��Ԫ���е�һ�����ܴ�������Ԫ����___�֣�SeO3�Ŀռ乹����___��
(2)������[EMIM][AlCl4]���кܸߵ�Ӧ�ü�ֵ��EMIM+�ṹ��ͼ��ʾ��
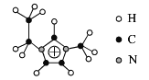
��EMIM+�����и�Ԫ�ص縺���ɴ�С��˳����___��
��EMIM+������̼ԭ�ӵ��ӻ��������Ϊ___��
�۴��������÷�����![]() ��ʾ������m��n�ֱ���������γɴ�������ԭ�����͵���������EMIM+�����еĴ�����Ӧ��ʾ___��
��ʾ������m��n�ֱ���������γɴ�������ԭ�����͵���������EMIM+�����еĴ�����Ӧ��ʾ___��
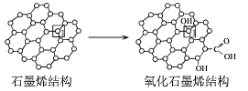
(3)ʯīϩ�в���̼ԭ�ӱ�������ת��Ϊ����ʯīϩ��ͼ��ʾ��ת����1��Cԭ��������Cԭ�Ӽ���ܱ�С��ԭ����___��
(4)GaAsΪԭ�Ӿ��壬�ܶ�Ϊ��gcm-3���侧���ṹ��ͼ��ʾ��Ga��As��ԭ�Ӱ뾶�ֱ�Ϊapm��bpm��GaAs������ԭ�ӵ����ռ��������İٷ���ΪA�����ӵ�������ֵΪNA=___��(����ĸ��ʾ)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʣ���ʯī�����Ȼ������壻�۾ƾ����ܰ�ˮ���ݶ�����̼����̼�����ƹ��壻���Ȼ�����Һ���ി����������ƹ��壻������
��1�����ڷǵ���ʵ���______________������ǿ����ʵ���__________������������ʵ���___________�����������գ�
��2��д�����ʢ�����ˮ��Һ�Լ��Ե�ԭ��_______�������ӷ���ʽ�ͼ�Ҫ����˵������
��3��д�����ʢ͢���ˮ�з�Ӧ�����ӷ���ʽ��_____________��
��4��������Һ��ʱͨ������������___________��Ȼ���ټ�ˮϡ�ͣ�ͨ��������Һ��_______��Ũ���Է�ֹ�䷢��ˮ�⡣
��5��Ũ�ȡ������ͬ�Ģں͢����Һ��������ͬ��״��������Zn������Ӧ���ʿ����___���������գ���pHֵ�������ͬ�Ģں͢����Һʱ������������������________�����������գ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(N2H4)������Ϊ��ɫҺ�壬���������ȼ�ϡ�����˵������ȷ����
��2O2(g)��N2(g)=N2O4(l) ��H1
��N2(g)��2H2(g)= N2H4(l) ��H2
��O2(g)��2H2(g)=2H2O(g) ��H3
��2 N2H4(l)��N2O4(l)=3N2(g)��4H2O(g) ��H4=1048.9 kJ��mol-1
A.��H4��2��H32��H2��H1
B.O2(g)��2H2(g)![]() 2H2O(l) ��H5����H5����H3
2H2O(l) ��H5����H5����H3
C.1 mol O2(g)�� 2 mol H2(g)������������� 2 mol H2O(g)
D.������ N2O4 ������ƽ�����ԭ��֮һ�Ƿ�Ӧ�ų����������Ҳ�������Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ﶬ���������߷��ļ��ڣ���������β����ȼúβ���������������Ҫԭ��֮һ��
��1����ҵ�����ü������ԭNO���ɼ��ٵ���������ŷš�
��֪��CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)��H=-574kJ��mol1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)��H=-1160kJ��mol1
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ_____________________________________��
��2������β���������ǿ�������β���ŷš���������β����Ⱦ������Ч���ֶΣ���Ҫԭ��Ϊ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)��H<0
N2(g)+2CO2(g)��H<0
T��ʱ���������ʵ�����NO��CO�����ݻ�Ϊ2L���ܱ������У������¶Ⱥ�������䣬��Ӧ����(0��15min)��NO�����ʵ�����ʱ��仯����ͼ��ʾ��
����֪��ƽ��ʱ����ķ�ѹ������������������ϵ����ѹǿ��T��ʱ�ﵽƽ�⣬��ʱ��ϵ����ѹǿΪp=20MPa����T��ʱ�÷�Ӧ��ѹ��ƽ�ⳣ��Kp��_______��ƽ����������¶Ȳ��䣬���������г���NO��CO2��0.3mol��ƽ�⽫_____(����������ҡ�����)�ƶ���
��15minʱ�����ı���練Ӧ����������n(NO)������ͼ��ʾ�ı仯����ı������������__(�����)
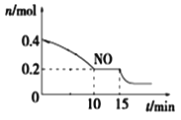
A.����COŨ��B.����C.��С�������D.�������
��3����ҵ�ϳ�����������Һ�������ķ�����ͬʱ����SO2���͵�������������(NOx)����������������Һ���տɵõ�Na2SO3��NaHSO3��NaNO2��NaNO3����Һ����֪�������£�HNO2�ĵ��볣��ΪKa=7��10-4��H2SO3�ĵ��볣��ΪKa1=1.2��10-2��Ka2=5.8��10-8��
�ٳ����£���ͬŨ�ȵ�Na2SO3��NaNO2��Һ��pH�ϴ����______��Һ��
�ڳ����£�NaHSO3��___��(�������������������������жϵ�������(ͨ������˵��)_____________��
��4����Ԫ��(Ce)����ϵ��������Ȼ�����ߵ�һ�֣�������+3��+4���ּ�̬�������к��д�������Ⱦ��NO�����Ա���Ce4+����Һ���գ�����NO2-��NO3-���������ʵ���֮��Ϊ1��1)���ɲ��õ�ⷨ����������Һ�е�NO2-ת��Ϊ�����ʣ�ͬʱ����Ce4+����ԭ����ͼ��ʾ��
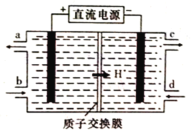
��Ce4+�ӵ��۵�_____(����ĸ����)��������
��д�������ĵ缫��Ӧʽ��_______________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com