
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:
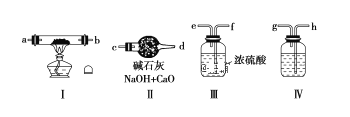
请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:
空气→Ⅳ→____→___→____(填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。
(2)装置Ⅳ中盛放的药品是____,其作用是_______。
(3)装置Ⅱ的作用是______。
(4)操作中通空气和加热的先后顺序为________。
(5)若去掉装置Ⅲ,装置Ⅰ中除反应生成Na2O2外,还可能发生的反应有______(写出两个化学方程式)。
【答案】Ⅲ Ⅰ Ⅱ NaOH溶液 吸收导入的空气中的CO2 吸收空气中的水蒸气和CO2,防止其进入Ⅰ装置,降低Na2O2纯度 先通空气,后加热 2Na+2H2O=2NaOH+H2↑,2Na2O2+2H2O==4NaOH+O2↑
【解析】
(1)金属钠和空气制备纯度较高的Na2O2,需要空气中的氧气和金属钠加热反应生成Na2O2,空气中的水蒸气和CO2,需要除去CO2后干燥;把空气通入IV中除去CO2,再通入浓硫酸中干燥,在装置I中加热生成Na2O2,装置II可防止空气中的CO2和水蒸气进入反应装置,据此分析作答;
(2)装置Ⅳ用于除去空气中的CO2,可以选择NaOH溶液;
(3)装置Ⅱ在整个实验的最后,用于防止空气中的CO2和水蒸气进入反应装置;
(4)实验时先通入足量的空气后再加热,可避免生成的Na2O2和CO2、水蒸气反应生成杂质;
(5)装置Ⅲ用于除去空气中的水蒸气,若去掉该装置,那么会发生金属钠与水的反应和过氧化钠与水的反应。
(1)由分析可知空气进入装置后先用氢氧化钠溶液除去CO2,再用浓硫酸干燥,最后金属钠与O2反应生成Na2O2,因此装置的连接顺序为:空气→Ⅳ→Ⅲ→Ⅰ→Ⅱ;
(2)装置Ⅳ用于除去空气中的CO2,一般选择NaOH溶液除去CO2;
(3)装置Ⅱ在整个实验的最后,用于防止空气中的CO2和水蒸气进入反应装置,因此装置Ⅱ的作用是吸收空气中的水蒸气和CO2,防止其进入Ⅰ装置,降低Na2O2纯度;
(4)为了避免生成的Na2O2和CO2、水蒸气反应生成杂质,应先通入足量的空气后再加热;
(5)装置Ⅲ用于除去空气中的水蒸气,若去掉该装置,那么会发生金属钠与水的反应和过氧化钠与水的反应,反应方程式分别为:2Na+2H2O=2NaOH+H2↑,2Na2O2+2H2O=4NaOH+O2↑。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行相关实验。
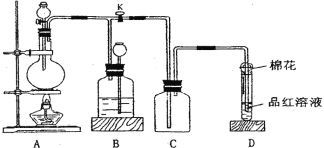
请回答:
(1)装置 A 中发生的化学反应方程式为________________________。
(2)装置 D 中试管口放置的棉花中可以浸上NaOH溶液, 其作用是_____________。
(3)装置 B 的作用是贮存多余的气体。当 D 处有明显的现象后,关闭旋塞 K 并移去酒精灯。B 中应放置的液体是(填字母) ____。
a.水 b.酸性 KMnO4 溶液 c.饱和 NaHSO3 溶液 d.浓溴水
(4)实验中,取一定质量的铜片和一定体积 18 mol·L—1 的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。有一定量的余酸但未能使铜片完全溶解,你认为可能的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B.透明的溶液中: Fe3+、Al3+、CO32-、SO42-
C.![]() =1012的溶液中:Na+、Ba2+、Cl-、AlO2-
=1012的溶液中:Na+、Ba2+、Cl-、AlO2-
D.c(HCO3-)=1 mol·L-1溶液中:Na+、NH4+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa;②0.1mol·L-1NaClO;③0.1mol·L-1Na2CO3;④0.1mol·L-1NaHCO3四种溶液的pH由大到小的关系为________________。(用序号填空)
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32- B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32- D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-=10-ymol·L-1,x与y的关系如图所示。

①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_______。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按甲方式混合后,所得溶液的pH为____________;
按乙方式混合后,其反应的离子方程式:_________________。
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.NaHS的水解:HS-+ H2O![]() S2-+ H3O+
S2-+ H3O+
B.NaHCO3在水溶液中的电离:HCO3+ H2O![]() H2 CO3+ OH
H2 CO3+ OH
C.NH4Cl的水解:NH4+ + H2O = NH3·H2O + OH
D.硫酸铝溶液和碳酸氢钠溶液混合: Al3+ + 3HCO3 = Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题:
(1)已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H1=-akJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H2=-bkJ/mol
H2O(l)=H2O(g) △H3=+ckJ/mol
则NH3(g)在氧气中燃烧生成氮气和液态水的热化学方程式为___。
(2)在合成工氨业中,氮气在催化剂Fe上的吸附分解反应活化能高、速率慢,因此氮气的反应速率决定了合成氨的反应速率。工业生产中,控制温度773K,压强3.0×105pa,原料中n(N2):n(H2)=1:2.8。请分析说明原料气中N2过量的理由___。
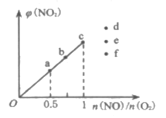
(3)已知反应2NO(g)+O2(g)![]() 2NO2(g),在恒温、恒容的密闭容器中按一定比例充入总物质的量一定的NO(g)和O2(g),平衡时NO2的体积分数[φ(NO2)]随
2NO2(g),在恒温、恒容的密闭容器中按一定比例充入总物质的量一定的NO(g)和O2(g),平衡时NO2的体积分数[φ(NO2)]随![]() 的变化如图所示。NO的转化率最小的是___点(填“a”、“b”、“c”);当
的变化如图所示。NO的转化率最小的是___点(填“a”、“b”、“c”);当![]() =1.5时,达到平衡状态时NO2的体积分数可能是___点(填“d”、“e”、“f”)。
=1.5时,达到平衡状态时NO2的体积分数可能是___点(填“d”、“e”、“f”)。
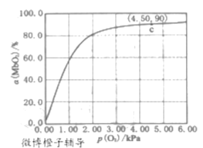
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,反应原理可表示为:Mb(aq)+O2(g)![]() MbO2(aq),该反应的平衡常数可表示为:K=
MbO2(aq),该反应的平衡常数可表示为:K=![]() 。37℃达到平衡时,测得肌红蛋白的结合度(a)与氧气分压[p(O2)]的关系如图所示[α=
。37℃达到平衡时,测得肌红蛋白的结合度(a)与氧气分压[p(O2)]的关系如图所示[α=![]() ×100%]。研究表明正反应速率v正=k正c(Mb)p(O2),逆反应速率v逆=k逆c(MbO2)(其中k正和k逆分别表示正、逆反应的速率常数).
×100%]。研究表明正反应速率v正=k正c(Mb)p(O2),逆反应速率v逆=k逆c(MbO2)(其中k正和k逆分别表示正、逆反应的速率常数).
①α(MbO2),先随p(O2)增大而增大,后来几乎不变,原因是___。
②试写出平衡常数K与速率常数k正、k逆之间的关系式K=___(用含有k正、k逆的式子表示)
③试求出图中c点时,上述反应的平衡常数K=___kPa-1。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
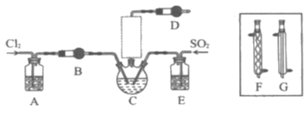
【题目】随着5G时代的到来,半导体材料将迎来快速发展,三氯化氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室利用PCl3、SO2、Cl2在60~65°C时反应制备POCl3和SOCl3的实验装置如图所示(气体的制备装置未画出)。
资料卡片:
物质 | 熔点/°C | 沸点/°C | 其他 |
PCl3 | -93.6 | 76.1 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 遇水剧烈水解,能溶于PCl3 |
SOCl3 | -105 | 78.8 | 遇水剧烈水解,受热易分解 |
(1)该反应的化学方程式为___。
(2)A、B装置中的试剂分别是___、___。
(3)装置E的作用是___。
(4)反应装置的虚线框中未画出的仪器最好选用___(填“F”或“G”),理由是___。
(5)反应结束后,提纯POCl3的操作是___(填操作名称)。
(6)测定某掺杂剂中POCl3的含量(杂质不参与反应):准确称取4.000g样品在水解瓶中摇动至完全水解,将水解液配成250mL溶液,取25.00mL于锥形瓶中,加入0.4000molL-1的AgNO3溶液25.00mL,再加少许硝基苯,用力振荡。加入NH4Fe(SO4)2作指示剂,用0.l000molL-1KSCN标准溶液滴定过量的AgNO3至终点,消耗KSCN标准溶液22.00mL。[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12,Ag3PO4可溶于硝酸,POCl3的相对分子质量为153.5]
①加入少量的硝基苯的目的是___。
②POCl3的质量分数为___。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种芳香酯类物质,也是一种重要的香料,工业上合成它的一种方法如下图所示。图中D的相对分子质量为106,D、E的核磁共振氢谱均只有两个峰,B经过氧化可以得到C。

已知:![]() R1CHO+HCOOH+R2CHO(R1、R2是烃基或者氢原子)。
R1CHO+HCOOH+R2CHO(R1、R2是烃基或者氢原子)。
(1)A的结构简式为___________________________,D的名称是___________________。
(2)D→E的反应类型为_______________,“一定条件”的内容是__________________。
(3)B中官能团的名称是__________,G的结构简式为___________________________。
(4)E→F的化学方程式为_________________。
(5)符合下列条件的F的同分异构体共有________种,写出一种核磁共振氢谱有5个峰的同分异构体的结构简式:________________________________。
①遇FeCl3溶液能发生显色反应 ②含有醚键
(6)写出以乙烯为原料合成HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
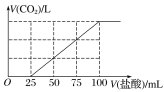
A. 原NaOH溶液的浓度为0.2 mol·L-1
B. 通入CO2在标准状况下的体积为448 mL
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com