
����Ŀ����100 mL NaOH��Һ��ͨ��һ������CO2���壬��ַ�Ӧ������������Һ����μ���0.2 mol��L��1�����ᣬ����CO2������������������֮���ϵ��ͼ��ʾ�������ж���ȷ����(����)
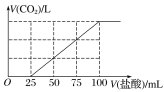
A. ԭNaOH��Һ��Ũ��Ϊ0.2 mol��L��1
B. ͨ��CO2�ڱ�״���µ����Ϊ448 mL
C. ������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaOH)��n(Na2CO3)��1��3
D. ������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaHCO3)��n(Na2CO3)��1��1
���𰸡�A
������������CO2�����ķ�ӦΪ��NaHCO3+HCl=NaCl+CO2��+H2O��̼���������ᷴӦ����̼�����Ƶķ���ʽΪ��Na2CO3+HCl=NaHCO3+NaCl���ɷ���ʽ��֪��ǰ��������������������Ӧ��ȣ�������ͼ���֪����CO2����������Һ�������100mL��25mL��75mL��25mL����˵��NaOH��CO2���巴Ӧ������Һ������ΪNa2CO3��NaHCO3��A������100mL����ʱ������̼����������ʱ��ҺΪNaCl��Һ�����������ӡ��������غ㣬����n��NaOH��=n��NaCl��=n��HCl��=0.1L��0.2mol/L=0.02mol������c��NaOH��=0.02mol��0.1L=0.2mol/L��A��ȷ��B�������߿�֪��25mL��100mLΪ̼�����������ᷴӦ���ɶ�����̼����Ӧ����ʽΪNaHCO3+HCl=NaCl+CO2��+H2O������n��CO2��=n��HCl��=��0.1L-0.025L����0.2mol/L=0.015mol������CO2�������Ϊ0.015mol��22.4L/mol=0.36L=336mL��B����C��Na2CO3ת��ΪNaHCO3��������Ϊ25mL������NaHCO3ת��Ϊ������̼�ֿ�����������25mL����NaOH��CO2���巴Ӧ������Һ��NaHCO3������������Ϊ75mL-25mL=50mL�����Na2CO3��NaHCO3�����ʵ���֮��Ϊ25mL��50mL=1��2��C����D����C�з�����֪D����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������������Ҫ�ɷ�ΪFeCO3,����SiO2��Al2O3���������ʣ�Ϊԭ���Ʊ��Ȼ������壨FeCl3��6H2O����ʵ��������£�

��1�����ܼ����������о��豣�����������Ŀ�ij��������Ԫ�صĽ�����֮�⣬����___________��
��2��������������_______________��
��3���μ�H2O2��Һ����ʱ��������Ҫ��Ӧ�����ӷ���ʽΪ_________________��
��4�������������У���μ�����Ԫ��ȫ����Fe3+��ʽ���ڣ�_______________________��
��5���������NaOH��Һ��Ŀ����__________________��
��6���벹�������ɹ��˺�õ��Ĺ����Ʊ�FeCl3��6H2O��ʵ�鷽��������˺����ù���______����ˮϴ�ӹ���2-3�Σ����¸���õ�FeCl3��6H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�����£���O2����a mol/L FeCl2��Һ�����������ʵ��������ͼ��ʾ�����з������Ʋ��������
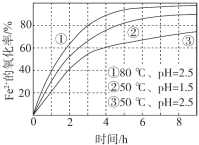
A. �ɢ١��ڿ�֪�� pHԽ��+2����Խ�ױ�����
B. �ɢڡ����Ʋ⣬��pH��7��+2�������ѱ�����
C. �ɢ١����Ʋ⣬FeCl2��O2�����ķ�ӦΪ���ȷ�Ӧ
D. 60�桢pH=2.5ʱ�� 4 h��Fe2+��ƽ���������ʴ��� 0.15a mol/(L��h)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.10mol��L��1KOH��Һ�ζ�10.00mL0.10mol��L��1H2C2O4(��Ԫ����)�ܣ����õζ�������ͼ��ʾ(�����Һ������ɿ��ɻ��ǰ��Һ�����֮��)������˵����ȷ���ǣ� ��
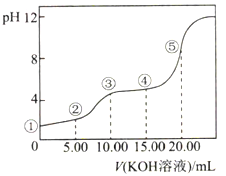
A. �����ʾ��Һ�У�c��H+��/c��OH-��=1012
B. �����ʾ��Һ�У�c(K+)+c(H+)=c(HC2O4��)+c(C2O42��)+c(OH��)
C. �����ʾ��Һ�У�c(K+)>c(HC2O4��)>c(H2C2O4)>c(C2O42��)
D. �����ʾ��Һ�У�c(K+)+c(H2C2O4)+c(HC2O4��)+ c(C2O42��)=0.10mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ����������ֶ�����Ԫ�ص�λ����ͼ��ʾ(�����ҡ���������λ��δ���)��
![]()
��֪����Ԫ�ص�ԭ������֮��Ϊ36���ҵ�ԭ��������ס���ԭ������֮����ȡ�
(1)��Ԫ�������ڱ��е�λ��Ϊ______________��
(2)���������γ�AB2�ͻ�����仯ѧʽΪ________��
(3)������Ȼ�����γɻ�������������Ԫ�أ������________(������)���䵥�����Ԫ�ص�����������Ӧˮ�����Ũ��Һ����ʱ��Ӧ�Ļ�ѧ����ʽ��______________________��
(4)���ס��ҡ�����������Ԫ����������ʱ��������������Ԫ�صõ��Ļ�����������࣬����________(��Ԫ�ط���)��д����Щ���������������ַ������������Ļ�ѧʽ______________________
(��ԭ�Ӹ�����Ϊ1��2���ڷ����м۵�������Ϊż��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4A(g)+3B(g)��2C(g)+D(g)����2min��B��Ũ�ȼ���0.6 molL-1���Դ˷�Ӧ���ʵı�ʾ��ȷ����( )
����A��ʾ�ķ�Ӧ������0.4 molL-1min-1
���ֱ���B��C��D��ʾ�ķ�Ӧ�������ֵΪ3��2��1
����2 minĩ�ķ�Ӧ���ʣ���B��ʾ��0.3 molL-1min-1
������2 min����B��ʾ�ķ�Ӧ���ʵ�ֵ����С�ģ���C��ʾ�ķ�Ӧ���ʵ�ֵ���������
A. �٢�
B. ��
C. ��
D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����������ԭ��Ӧ���ǣ�������
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ0.3mol/LNaOH��Һ480mL��������Һ����������ش��������⡣
��1����ͼ��ʾ������������Һ�����õ��IJ���������__(����������)��
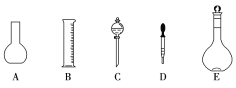
��2�����в����У�����ƿ�����߱��Ĺ�����___(�����)��
A������һ�����ȷŨ�ȵı���Һ
B��������Һ
C����������ƿ������µ����������Һ��
D��ȷϡ��ijһŨ�ȵ���Һ
E�����������ܽ��������
��3�����ݼ��㣬��������ƽ��ȡNaOH������Ϊ___g����ʵ����������������ȷ��������ʱ���ӿ̶��ߣ���������ҺŨ��___(�ƫ�����䡱��ƫС����ͬ)����NaOH��Һ��ת��������ƿʱ����������������������ҺŨ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵ�ѭ�������е���Ҫ���ʣ����ĺϳ���Ŀǰ�ձ�ʹ�õ��˹��̵�������
��1��������ͼ�ṩ����Ϣ��д���÷�Ӧ���Ȼ�ѧ����ʽ___����ͼ��������__���a����b������ʾ��������ý���������������仯���ߡ�
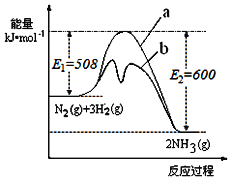
��2���ں��������У�������������˵��������Ӧ�Ѵ�ƽ�����___��
A��3��(H2)����2��(NH3)��
B����λʱ��������nmolN2��ͬʱ����2nmolNH3
C��������������ܶȲ���ʱ��ı仯���仯
D��������ѹǿ����ʱ��ı仯���仯
��3��500�桢50MPaʱ�����ݻ�Ϊ1L�������м���1molN2��3molH2����Ӧ��ƽ�����ƽ�ⳣ��ΪK����ʱN2��ת����Ϊa����K��a�Ĺ�ϵ��K��___��
��4��1998��ϣ������˹��´�ѧ����λ��ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+����ʵ���˸��³�ѹ�¸�ת���ʵĵ��ϳɰ�����ʵ��װ����ͼ�������ĵ缫��ӦʽΪ___��
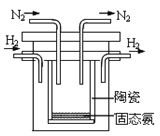
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com