
【题目】在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
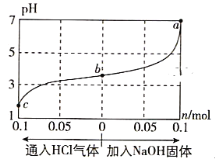
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数![]()
【答案】D
【解析】
A. CH3COOH溶液与0.1molNaOH固体混合,CH3COOH+NaOH![]() CH3COONa+H2O,形成CH3COOH和CH3COONa的混合溶液,其中CH3COONa的水解促进水的电离,CH3COOH的电离抑制水的电离。若向该混合溶液中通入HCl,c点反应CH3COONa+HCl
CH3COONa+H2O,形成CH3COOH和CH3COONa的混合溶液,其中CH3COONa的水解促进水的电离,CH3COOH的电离抑制水的电离。若向该混合溶液中通入HCl,c点反应CH3COONa+HCl![]() CH3COOH+NaCl恰好完全发生,CH3COONa减少,CH3COOH增多;若向该混合溶液中加入NaOH 固体,a点反应CH3COOH+NaOH
CH3COOH+NaCl恰好完全发生,CH3COONa减少,CH3COOH增多;若向该混合溶液中加入NaOH 固体,a点反应CH3COOH+NaOH![]() CH3COONa+H2O恰好完全进行,CH3COONa增多,CH3COOH减少,因此,水的电离程度: a>b>c,故A正确;
CH3COONa+H2O恰好完全进行,CH3COONa增多,CH3COOH减少,因此,水的电离程度: a>b>c,故A正确;
B.CH3COOH溶液与0.1molNaOH固体混合,CH3COOH+NaOH![]() CH3COONa+H2O,形成CH3COOH和CH3COONa的混合溶液,b点溶液呈酸性,说明CH3COOH浓度远大于CH3COONa,c点CH3COONa与HCl反应完全,溶液呈酸性,此时溶液为CH3COOH和NaCl溶液,则c(CH3COOH)>c(Na+)>c(OH-),故B正确;
CH3COONa+H2O,形成CH3COOH和CH3COONa的混合溶液,b点溶液呈酸性,说明CH3COOH浓度远大于CH3COONa,c点CH3COONa与HCl反应完全,溶液呈酸性,此时溶液为CH3COOH和NaCl溶液,则c(CH3COOH)>c(Na+)>c(OH-),故B正确;
C.a点反应CH3COOH+NaOH![]() CH3COONa+H2O恰好完全进行,溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),此时pH=7,则c(H+)= c(OH-),则c(Na+)= c(CH3COO-),故C正确;
CH3COONa+H2O恰好完全进行,溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),此时pH=7,则c(H+)= c(OH-),则c(Na+)= c(CH3COO-),故C正确;
D. 该温度下pH=7时,c(H+)=10-7mol·L-1,c(CH3COO-)=c(Na+)=0.2mol/L,c(CH3COOH)=(c-0.2)mol/L,则醋酸的电离平衡常数Ka=![]() =
=![]() ,故D错误;
,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】绝热容器中发生反应:3Z(s)![]() X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法不正确的是
X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法不正确的是
A.将0.3 mol Z置于容器中充分反应生成气体的物质的量一定小于0.3 mol
B.达到化学平衡状态时,气体平均摩尔质量不变
C.容器中放入3mol Z,达到化学平衡状态时,反应吸收的总热量为a kJ
D.容器温度不变,反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)![]() NH2COONH4(s) H1
NH2COONH4(s) H1
反应II:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g) H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) H3=-86.98kJ/mol
CO(NH2)2(s)+H2O(g) H3=-86.98kJ/mol
请回答下列问题:
①反应I的H1=__kJ/mol。
②反应II一般在__(填“高温或“低温")条件下有利于该反应的进行。
③一定温度下,在体积固定的密闭容器中按计量比投料进行反应I,下列能说明反应达到了平衡状态的是__(填字母序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2v正(NH3)=v逆(CO2)
D.容器内混合气体的密度不再变化
(2)将CO2和H2按物质的量之比为1:3充入一定体积的密闭容器中,发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H。测得CH3OH的物质的量在不同温度下随时间的变化关系如图所示。
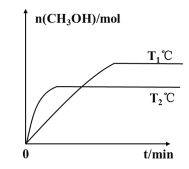
①根据图示判断H__0(填“>”或“<”)。
②一定温度下,在容积均为2L的两个密闭容器中,按如下方式加入反应物,10min后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmolCH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始时的0.8倍,则反应10min内甲容器中以CH3OH(g)表示的化学反应速率为__,此温度下的化学平衡常数为__(保留两位小数);要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为__。
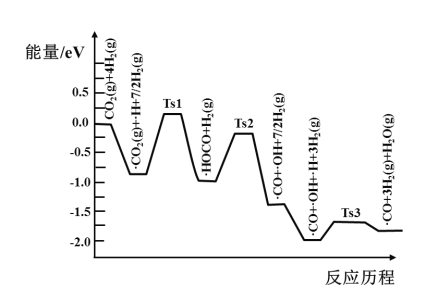
(3)氢气可将CO2还原为甲烷,反应为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会__(填“放出热量”或“吸收热量”);反应历程中最小能垒(活化能)步骤的化学方程式为__。
CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会__(填“放出热量”或“吸收热量”);反应历程中最小能垒(活化能)步骤的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
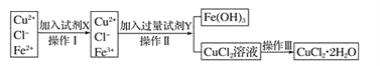
请参照下表给出的数据填空。

(1)操作I加入X的目的是___________________________ 。
(2)下列物质都可以作为X,适合本实验的X物质可以是_________(填字母)。
A KMnO4 B NaClO C H2O2 D Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)__________________________________________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下在一容积恒为2L的容器内发生反应:2A(g)+B(g2C(g),已知起始投入4molA(g)和2molB(g),经2s后测得C的浓度为0.6mol/L,并且2s后各组分浓度不再改变。下列说法正确的是
A.2 s 内用物质A 表示的平均反应速率为 0.6 mol/(Ls)
B.2 s 内用物质B 表示的平均反应速率为 0.15mol/(Ls)
C.2 s 后每有 0.6 mol 的物质B 生成,同时有 0.6 mol 物质C 生成
D.2 s 时物质B 的浓度为 0.7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和 CO2 发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 CO2 气体,反应过程中 CO2 气体和 CO 气体的浓度与时间的关系如图所示:

(1)t1 时,正、逆反应速率的大小关系为 v 正_____v 逆(填“>”“<”或“=”)。
(2)4 min 内,CO 的平均反应速率 v(CO)=_____。
(3)下列条件的改变能减慢其反应速率的是_____(填序号,下同)。
①降低温度
②减少铁粉的质量
③保持压强不变,充入 He 使容器的体积增大
④保持容积不变,充入 He 使体系压强增大
(4)下列描述能说明上述反应已达平衡状态的是_____。
①v(CO2)=v(CO)
②单位时间内生成 n mol CO2 的同时生成 n mol CO
③容器中气体压强不随时间变化而变化
④容器中气体的平均相对分子质量不随时间变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Fe原子的简化电子排布式为______________________。
(2)常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂。写出CO的电子式______________;Fe(CO)5分子中σ键与π键之比为______________。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中第一电离能最大的元素是_____________;(SCN)2分子中硫原子的杂化方式是_____________;
(4)硝酸铜溶于氨水形成[Cu(NH3)4](NO3)2的深蓝色溶液。
①[Cu(NH3)4](NO3)2中阴离子的立体构型是_________________。
②与NH3互为等电子体的一种阴离子为_____________(填化学式);氨气在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因__________。
(5)金属晶体可看成金属原子在三维空间中堆积而成,单质铝中铝原子采用铜型模式堆积,原子空间利用率为74%,则铝原子的配位数为________________。
(6)铁和硫形成的某种晶胞结构如右图所示,晶胞参数a=xpm,则该物质的化学式为___________________;A原子距离B原子所在立方体侧面的最短距离为________________pm(用x表示); 该晶胞的密度为____________g·cm-3。(阿伏加德罗常数用NA表示)
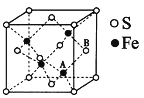
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个装置,下列说法错误的是( )
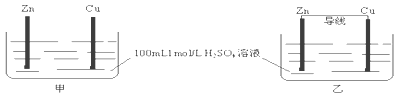
A. 甲、乙装置中,Zn的质量均减小B. 甲、乙装置中,Cu上均有气泡产生
C. 化学反应速率乙>甲D. 甲中H+移向Zn,乙中H+移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗结肠炎药物Y结构如图所示,以下说法错误的是

A. 该有机物既能和酸反应又能和碱反应
B. 1mol该有机物可以和2molNaOH发生反应
C. 该有机物可以发生缩聚反应
D. 该有机物不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com