
【题目】(1)基态Fe原子的简化电子排布式为______________________。
(2)常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂。写出CO的电子式______________;Fe(CO)5分子中σ键与π键之比为______________。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中第一电离能最大的元素是_____________;(SCN)2分子中硫原子的杂化方式是_____________;
(4)硝酸铜溶于氨水形成[Cu(NH3)4](NO3)2的深蓝色溶液。
①[Cu(NH3)4](NO3)2中阴离子的立体构型是_________________。
②与NH3互为等电子体的一种阴离子为_____________(填化学式);氨气在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因__________。
(5)金属晶体可看成金属原子在三维空间中堆积而成,单质铝中铝原子采用铜型模式堆积,原子空间利用率为74%,则铝原子的配位数为________________。
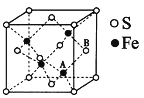
(6)铁和硫形成的某种晶胞结构如右图所示,晶胞参数a=xpm,则该物质的化学式为___________________;A原子距离B原子所在立方体侧面的最短距离为________________pm(用x表示); 该晶胞的密度为____________g·cm-3。(阿伏加德罗常数用NA表示)
【答案】[Ar] 3d64s2 ![]() 1:1 N sp3杂化 平面三角形 CH3- NH3通过氢键形成“缔合”分子,分子间作用力增强,分子间距离减小,导致密度反常增大。 12 FeS 0.25x
1:1 N sp3杂化 平面三角形 CH3- NH3通过氢键形成“缔合”分子,分子间作用力增强,分子间距离减小,导致密度反常增大。 12 FeS 0.25x ![]()
【解析】
(1)铁元素位于周期表中第四周期第Ⅷ族,原子序数是26,其基态原子的简化电子排布式为[Ar]3d64s2;
(2)CO分子中C与O原子形成了三键,其电子式为:![]() ;Fe(CO)5是由CO和Fe形成的羰基配合物,所以分子中σ键总数为10,π键总数为10,所以二者个数比例为1:1;
;Fe(CO)5是由CO和Fe形成的羰基配合物,所以分子中σ键总数为10,π键总数为10,所以二者个数比例为1:1;
(3)周期表中从左至右,第一电离能呈现增大趋势,从下至上第一电离能呈现增大趋势,此外,相同周期ⅡA第一电离能大于ⅢA的,ⅤA第一电离能大于ⅥA的,所以Ni(SCN)2中N元素的第一电离能最大;(SCN)2的结构为![]() ,S原子形成2个成键电子对以及2个孤电子对,总计4个价层电子对,所以S原子采用的是sp3的杂化方式;
,S原子形成2个成键电子对以及2个孤电子对,总计4个价层电子对,所以S原子采用的是sp3的杂化方式;
(4)①![]() 中有3个成键电子对,经过计算不含孤电子对,所以
中有3个成键电子对,经过计算不含孤电子对,所以![]() 是平面三角形;
是平面三角形;
②书写与NH3互为等电子体且为阴离子的粒子时,可以考虑用族序数比N元素小的其他元素代替N元素,如C,所以可以为![]() ;氨分子之间可以形成氢键,因此可能会通过氢键形成缔合分子,分子间作用力增强,分子间间距减小,进而导致密度比理论密度大;
;氨分子之间可以形成氢键,因此可能会通过氢键形成缔合分子,分子间作用力增强,分子间间距减小,进而导致密度比理论密度大;
(5)单质铜采用的是面心立方最密堆积,Al与Cu采用相同的堆积方式,所以Al的配位数也是12;
(6)由晶胞的结构可知,Fe存在于晶胞的内部,一共有4个,S存在于晶胞的顶点和面心上,所以均摊法计算一个晶胞有4个S原子,晶胞中Fe与S的个数比为1:1,所以该物质的化学式为FeS;由FeS的晶胞结构可知,其与ZnS具有相似的晶胞结构,将晶胞八等分,那么A原子则位于下层四个小正方体中右侧的正方体的体心,所以与B原子所在平面的距离即晶胞边长的![]() ,即0.25xpm;根据晶胞结构,列式计算,晶胞的密度为:
,即0.25xpm;根据晶胞结构,列式计算,晶胞的密度为: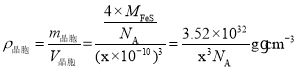 。
。


科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,11.2L的己烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.2.8g 的聚乙烯中含有的碳原子数为0.2 NA
D.1mol 乙醇中含有碳氢键的数目为6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于自然界中氮循环(如图)的说法正确的是
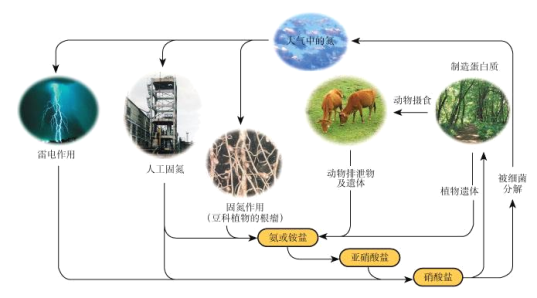
A. 氮元素仅被还原B. 含氮无机物和含氮有机物可相互转化
C. 工业合成氨属于人工固氮D. 碳、氢、氧三种元素也参与了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
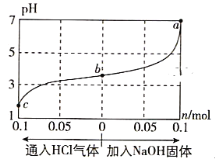
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体,难溶于CCl4。实验室可将干燥二氧化碳和干燥氨气通入CCl4中进行制备,化学方程式为:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH<0。
回答下列问题:
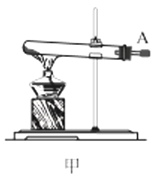
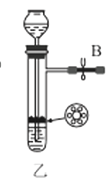

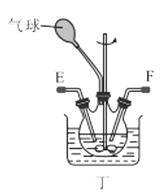
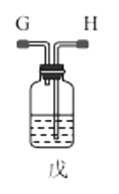
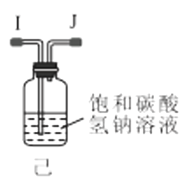
(1)利用装置甲制备氨气的化学方程式为__。
(2)简述检查装置乙气密性的操作__。
(3)选择图中的装置制备氨基甲酸铵,仪器接口的连接顺序为:B→__→__→EF←__←A。
(4)反应时为了增加氨基甲酸铵的产量,三颈瓶的加热方式为__(填“热水浴”或“冷水浴”);丁中气球的作用是__。
(5)从装置丁的混合物中分离出产品的方法是__(填写操作名称)。
(6)取因吸潮变质为碳酸氢铵的氨基甲酸铵样品11.730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥、称量,质量为15.000g。则样品中氨基甲酸铵的质量分数为__(已知:Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100。计算结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属铁的腐蚀与防护,说法正确的是( )
A. 酸雨后易发生析氢腐蚀、炒锅存留盐液时易发生吸氧腐蚀
B. 当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀
C. 铁与电源正极连接可实现电化学保护
D. 为了降低水库铁闸门被腐蚀的速率,可以采用如图方案,在铁闸门上焊接金属铜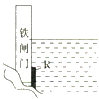
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 °C时,用浓度为0.1000 mol/L的NaOH溶液滴定体积均是20mL、浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )
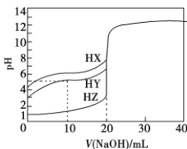
A.酸性强弱顺序是HX> HY> HZ
B.加入10 mL NaOH溶液时,HY溶液中c(Na+ )>c(Y -)
C.pH=2的HZ溶液加水稀释10倍,pH为3
D.加入20 mL NaOH溶液时,只有HY溶液达到滴定终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向体积为2L的容器中加入2molO2和3molSO2使之反应生成SO3气体:2SO2+O2![]() 2SO3,2min时,测得O2的物质的量为1.6mol,则:
2SO3,2min时,测得O2的物质的量为1.6mol,则:
(1)2min内,平均反应速率υ(SO3)=_____________
(2)2min时,SO2的浓度为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A.48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
B.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
C.标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D.4.5 g SiO2晶体中含有的硅氧键数为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com