
【题目】在一定条件下,向体积为2L的容器中加入2molO2和3molSO2使之反应生成SO3气体:2SO2+O2![]() 2SO3,2min时,测得O2的物质的量为1.6mol,则:
2SO3,2min时,测得O2的物质的量为1.6mol,则:
(1)2min内,平均反应速率υ(SO3)=_____________
(2)2min时,SO2的浓度为_____________
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)![]() NH2COONH4(s) H1
NH2COONH4(s) H1
反应II:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g) H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) H3=-86.98kJ/mol
CO(NH2)2(s)+H2O(g) H3=-86.98kJ/mol
请回答下列问题:
①反应I的H1=__kJ/mol。
②反应II一般在__(填“高温或“低温")条件下有利于该反应的进行。
③一定温度下,在体积固定的密闭容器中按计量比投料进行反应I,下列能说明反应达到了平衡状态的是__(填字母序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2v正(NH3)=v逆(CO2)
D.容器内混合气体的密度不再变化
(2)将CO2和H2按物质的量之比为1:3充入一定体积的密闭容器中,发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H。测得CH3OH的物质的量在不同温度下随时间的变化关系如图所示。
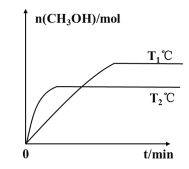
①根据图示判断H__0(填“>”或“<”)。
②一定温度下,在容积均为2L的两个密闭容器中,按如下方式加入反应物,10min后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmolCH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始时的0.8倍,则反应10min内甲容器中以CH3OH(g)表示的化学反应速率为__,此温度下的化学平衡常数为__(保留两位小数);要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为__。
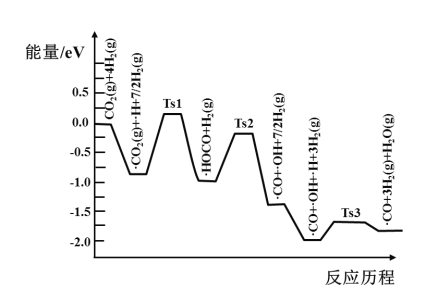
(3)氢气可将CO2还原为甲烷,反应为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会__(填“放出热量”或“吸收热量”);反应历程中最小能垒(活化能)步骤的化学方程式为__。
CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会__(填“放出热量”或“吸收热量”);反应历程中最小能垒(活化能)步骤的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Fe原子的简化电子排布式为______________________。
(2)常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂。写出CO的电子式______________;Fe(CO)5分子中σ键与π键之比为______________。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中第一电离能最大的元素是_____________;(SCN)2分子中硫原子的杂化方式是_____________;
(4)硝酸铜溶于氨水形成[Cu(NH3)4](NO3)2的深蓝色溶液。
①[Cu(NH3)4](NO3)2中阴离子的立体构型是_________________。
②与NH3互为等电子体的一种阴离子为_____________(填化学式);氨气在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因__________。
(5)金属晶体可看成金属原子在三维空间中堆积而成,单质铝中铝原子采用铜型模式堆积,原子空间利用率为74%,则铝原子的配位数为________________。
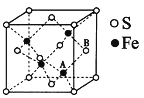
(6)铁和硫形成的某种晶胞结构如右图所示,晶胞参数a=xpm,则该物质的化学式为___________________;A原子距离B原子所在立方体侧面的最短距离为________________pm(用x表示); 该晶胞的密度为____________g·cm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个装置,下列说法错误的是( )
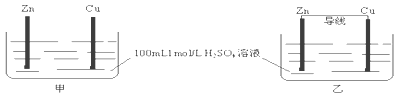
A. 甲、乙装置中,Zn的质量均减小B. 甲、乙装置中,Cu上均有气泡产生
C. 化学反应速率乙>甲D. 甲中H+移向Zn,乙中H+移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质进行分类(填序号)
①O2与O3②![]() C 与
C 与![]() C③白磷与红磷④冰与水⑤H2、D2、T2⑥乙醇与二甲醚⑦
C③白磷与红磷④冰与水⑤H2、D2、T2⑥乙醇与二甲醚⑦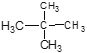 和
和![]()
(1)互为同位素的是_________。
(2)互为同素异形体的是_________。
(3)互为同分异构体的是_________。
(4)属于同一化合物的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol·L1的NaOH溶液分别滴定均为20.00mL0.100mol·L1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是
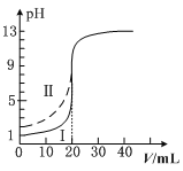
A.Ⅰ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL
C.V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D.V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在利用镁条与醋酸的反应研究化学反应速率的影响因素的实验中,同学们记录了相同体积、不同浓度的醋酸与足量Mg条反应,产生H2体积随时间变化的数据,并以单位时间内产生H2的体积来表示反应速率,其反应速率随时间变化的图(如图所示)。
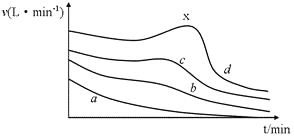
(1)在a、b、c、d四条曲线中,对应醋酸溶液的物质的量浓度最小的是_________,反应最后产生的H2在相同条件下体积最大的是_____________。
(2)在d曲线中,反应一段时间以后,反应速率出现反常的升高的现象(x点附近)。产生这种现象的原因主要是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗结肠炎药物Y结构如图所示,以下说法错误的是

A. 该有机物既能和酸反应又能和碱反应
B. 1mol该有机物可以和2molNaOH发生反应
C. 该有机物可以发生缩聚反应
D. 该有机物不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞德西韦(Remdesivir)是一种核苷类似物,具有抗病毒活性,对新型冠状病毒(2019-nCoV)病例展现出较好的疗效。其结构如图a所示,回到下列问题:
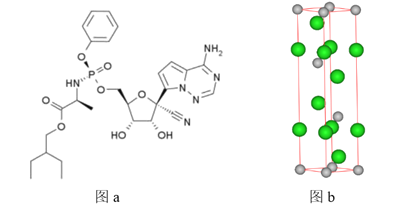
(1)该结构中P原子价电子的轨道表示式为_________。
(2)该结构中处于第二周期原子第一电离能从大到小的顺序为_______(用化学用语回答)。
(3)该结构氨基中N的杂化方式为_________,该分子间的作用力有________。
(4)苯酚(C6H5OH)为合成反应物之一,苯酚的晶体类型是_________,与甲苯(![]() )的相对分子质量相近,但苯酚的熔沸点高于甲苯,原因是________。
)的相对分子质量相近,但苯酚的熔沸点高于甲苯,原因是________。
(5)某镨(59Pr)的化合物是合成该分子的催化剂之一,则镨元素位于元素周期表中的__________区。MgCl2也是合成瑞德西韦的催化剂,晶胞如图b所示,则Mg2+处于氯离子围成的___________空隙中。晶胞参数为acm、acm、bcm,则该晶体的密度为_____________g/cm3。(填表达式,已知底面夹角分别为120°、60°,侧面与底面垂直)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com