
A. 烧杯 | B. 胶头滴管 | C. 容量瓶 | D. 试管 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.②⑦③④⑥ | B.⑥②⑦③④ | C.②⑥③⑦⑤ | D.②⑦③⑥⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
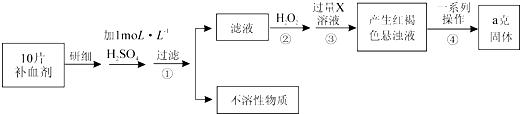
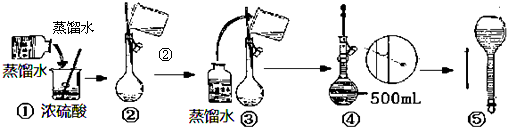
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
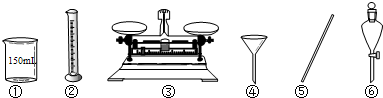
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用天平准确称取19.1g碳酸钠固体 |
| B.将固体在烧杯中溶解后,应立即将溶液转移至容量瓶中 |
| C.烧杯中的溶液转移后,由于残留量很少,可以不必再洗涤烧杯和玻璃棒 |
| D.如果在最后定容时,滴入的水超过了容量瓶的刻度线,实验必须重做 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com