
【题目】随着网络信息时代不断的发展,人和事件在网络上曝光的几率更大了,所以网络红人也逐渐的增加起来。2018年8月9日,美国男子为了变成网络红人,居然用漂白粉洗澡,结果差点被送进医院。太和一中为塑造中学生正确的价值观,结合此事发出“好学的中学生是最红的”倡议,我校理化创新社的同学发现教材在提到某些物质的用途时,仅指出该物质常用做漂白剂,并没有对其漂白原理及应用范围进行介绍,为响应学校的倡议,决定邀请你一起在全校普及漂白剂知识。查阅资料可知常见的六种漂白剂有:活性炭、氯水、过氧化氢、过氧化钠、臭氧、二氧化硫。请你帮助理化创新社的同学解决以下问题:
I.为探究和比较SO2和氯水的漂白性,理化创新社的同学设计了如的实验装置。

⑴实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:________________;
⑵实验室用装置E制备Cl2,其反应的化学化学方程式为:________________;
⑶①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B:________________,D:________________;
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:B:________________,D:________________;
⑷一位同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)________________;
II.很多同学认为往过氧化钠固体完全溶解反应后的溶液中滴加酚酞只会变红而不会褪色,而理化创新社的同学在实验中发现酚酞变红后又褪色。请帮助他们探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后褪色的原因:
⑸过氧化钠与水反应的化学方程式为:________________;
⑹经查阅文献发现过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不是很稳定且具有漂白性的物质X,X的化学式是________________;
⑺查阅资料发现过氧化钠与水的反应可以认为存在2步反应。请你尝试写出这2步化学反应的化学方程式:①________________;
②________________;
⑻下列说法正确的是________________。
A.利用SO2的漂白性可使酸性高锰酸钾溶液褪色
B.漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂
C.为便于储存和使用,可用液氯代替氯水漂白干燥棉布上的有色物质
D.制造白糖工业中可用活性炭做脱色剂,是利用了活性炭的物理吸附能力
E.臭氧的漂白原理和双氧水不相同
【答案】分液漏斗的塞子没有取下来 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 品红褪色 品红褪色 褪色的品红又恢复成红色 无明显现象 Cl2+SO2+2H2O= 2HCl+H2SO4 2Na2O2+2H2O = 4NaOH+O2↑ H2O2 Na2O2+2H2O= 2NaOH+H2O2 2H2O2= 2H2O+O2↑ BD
MnCl2+Cl2↑+2H2O 品红褪色 品红褪色 褪色的品红又恢复成红色 无明显现象 Cl2+SO2+2H2O= 2HCl+H2SO4 2Na2O2+2H2O = 4NaOH+O2↑ H2O2 Na2O2+2H2O= 2NaOH+H2O2 2H2O2= 2H2O+O2↑ BD
【解析】
实验室用亚硫酸钠和浓硫酸反应生成二氧化硫,二氧化硫具有漂白性,通入品红溶液,品红溶液褪色,加热褪色后的溶液,又变为红色,说明二氧化硫的漂白是可逆性的漂白;实验室用二氧化锰和浓盐酸加热反应生成氯气,氯气通入到品红中,品红溶液褪色,并不是氯气有漂白性,而是氯气与水反应生成次氯酸,次氯酸具有漂白性,加热褪色的溶液,无现象,说明次氯酸的漂白是永久性漂白。
过氧化钠与水反应,滴加酚酞溶液,溶液先变红后褪色,说明不仅生成了碱,还生成了具有漂白性的物质,根据质量守恒得到NaOH溶液和过氧化氢。
⑴塞子没有取下来,打开活塞时,空气无法进入分液漏斗内部,造成分液漏斗内的压强小于大气压强,液体无法流出,故答案为:分液漏斗的玻璃塞没有取下来。
⑵实验室用装置E制备Cl2,其反应的化学化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
⑶①SO2具有漂白性,二氧化硫通入品红溶液中,品红褪色;氯气和水反应生成的次氯酸具有漂白性,因而氯气通入品红溶液中也能使品红褪色;故答案为:品红褪色;品红褪色。
②SO2的漂白具有可逆性,褪色后的溶液加热时又恢复原来的红色;次氯酸的漂白不可逆,加热时,不能恢复红色;故答案为:褪色的品红又恢复成红色;无明显现象。
⑷氯气具有较强的氧化性,二氧化硫具有较强的还原性,在水溶液中两者1:1发生反应:Cl2+SO2+2H2O═2HCl+H2SO4,生成物都无漂白性,因而SO2和Cl2按1:1同时通入到品红溶液时,品红溶液并不褪色;故答案为:Cl2+SO2+2H2O==2HCl+H2SO4。
⑸过氧化钠与水反应生成氢氧化钠和氧气生成,反应方程式为:2Na2O2+2H2O = 4NaOH + O2↑;故答案为:2Na2O2+2H2O = 4NaOH+O2↑。
⑹过氧化钠与水反应过程中,钠元素形成了稳定的化合物,其它元素组合形成的不很稳定、具有漂白性的物质X,X只能为具有强氧化性的H2O2;故答案为:H2O2。
⑺根据实验现象及其质量守恒定律可以推知中间产物为具有氧化性的过氧化氢,双氧水不稳定,分解生成水和氧气,因此反应方程式分别为:Na2O2+2H2O = 2NaOH+H2O2;2H2O2= 2H2O+O2↑;故答案为:Na2O2+2H2O = 2NaOH+H2O2;2H2O2= 2H2O+O2↑。
⑻A. SO2具有还原性,能使酸性高锰酸钾溶液褪色,与SO2的漂白性无关系,故A错误;
B. 漂白粉的有效成分是次氯酸钙,漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂,故B正确;
C. 氯气没有漂白性,真正起漂白剂作用的是氯气与水反应生成的次氯酸,因此液氯没有漂白性,故C错误;
D. 活性炭漂白的本质原因是由于活性炭的比表面积很大,具有很强的吸附能力,所以制造白糖工业中可用活性炭做脱色剂,是利用了活性炭的物理吸附能力,故D正确;
E. 臭氧和双氧水漂白都利用了强氧化性,故漂白原理相同,故E错误;
综上所述,答案为BD。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法不正确的是( )
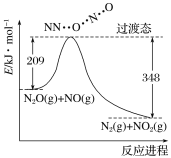
A.反应生成1 mol N2时转移4 mol e-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139 kJ·mol-1
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
10min | 20min | 30min | 40min | 50min | 60min | |
300℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
500℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
A. 该反应的焓变ΔH > 0,升高温度K增大
B. 300℃时,0-20 min H2的平均反应速率 v (H2)= 0.003mol/(L·min)
C. 采取加压、增大H2浓度、加入催化剂的措施都能提高CO的转化率
D. 500℃下,向该容器中初始加入0.1 mol CO和0.3 mol H2,依据现有数据可计算反应达平衡后甲醇的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况(不计CO2的溶解),则下列对应图形的判断正确的是
A. 含有两种溶质 B. 只含有一种溶质
B. 只含有一种溶质 C. 只含有碳酸钠
C. 只含有碳酸钠 D. 有碳酸钠和碳酸氢钠
D. 有碳酸钠和碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯乙烯的结构为![]() 。有关该物质的下列说法正确的是
。有关该物质的下列说法正确的是
A. 该物质能使溴水和酸性髙锰酸钾溶液褪色,褪色原理完全相同
B. 苯乙烯分子的所有原子不可能在同一平面上
C. 该物质苯环上的一溴取代物有3种
D. 除去乙苯中混有的苯乙烯,可以通入等量氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家用氮化鎵材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2下列有关说法中正确的是( )
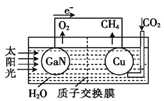
A. 该装置只有化学能转化为电能
B. 氮化镓电极是阴极
C. 导线中经过2mol的电子,氮化镓电极生成lmol O2
D. 铜电极表面的电极反应式:CO2+8e-+8H+=CH4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是

A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙酸乙酯常用于合成人造香料,其合成路线如图所示(部分反应条件略去):
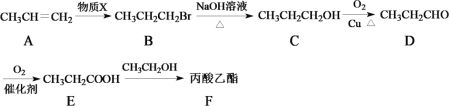
(1)化合物B的分子式是___________,化合物C中含氧官能团的名称为___________。
(2)E→F的化学反应方程式是___________,反应类型是___________。
(3)A→B的反应是加成反应,则物质X的化学式为___________。
(4)E→F转化中有多种有机副产物,其中一种副产物Q的相对分子质量为74,氢的质量分数为13.51%,分子中碳氢原子个数比是2∶5,则Q的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.化学反应的实质是旧键的断裂,新键的生成
B.CH4、CF4、CCl4、CBr4 熔、沸点逐渐升高,原因是分子间作用力逐渐增大
C.NH3 和 H2O 分子间都可以形成氢键
D.NH4H 是离子化合物,其含有离子键、极性键、非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com