
中学常见的某反应的化学方程式为a+b→c+d+H2O(未配平,反应条件略去)。
请回答下列问题:
(1)若a是铁,b是稀硝酸(过量)且a可溶于c溶液中。则a与b反应的离子方程式为
(2)若c,d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪去,写出其褪色过程的离子方程式为
(3)若c是无色刺激性气味的气体,其水溶液显弱碱性,在标准状况下用排空气法收集c气体得平均摩尔质量为20g·mol-1的混合气体进行喷泉实验。假设溶质不扩散,实验完成后所得溶液的物质的量浓度为_ mol·L-1。(小数点后保留2位有效数字)
(4)若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5。则上述反应的离子方程式为 。
(1)Fe+4H++NO3-=Fe3++NO↑+H2O;
(2)SO2+Br2+2H2O=4H++SO42-+2Br-;
(3)0.045;
(4)4CO2+5OH-=CO32-+3HCO3- +H2O。
解析试题分析:(1)Fe可溶于c溶液中,可知C溶液为Fe3+的溶液;(2)可使澄清石灰水变浑浊的气体为SO2和CO2,其中SO2气体可以使溴水褪色;(3)C气体为NH3,进行喷泉实验进入烧瓶中水的体积等于原混合气体中氨气的体积,因此有c(NH3)=1/22.4=0.045mol·L-1;(4)造成温室效应的主要气体为CO2,c、d均为钠盐可判定其分别为Na2CO3和NaHCO3,因此结合物质的量之比为4:5可书写出化学方程式。
考点:离子方程式的书写和配平。


科目:高中化学 来源: 题型:填空题
对一瓶无色、澄清的稀溶液作初步分析后发现,其中可能含有SO42-、Na+、CO32-、H+、NO3-、HCO3-、Cl-等离子中的若干种。进一步的分析结果如下:
(1)用pH试纸测定溶液的pH,试纸呈红色(酸性色)
(2)取2mL溶液滴加少量BaCl2溶液,有白色沉淀生成,再滴加少量稀HNO3,沉淀不消失
(3)对(2)中所得的混合物,充分静置后,取上层清液滴加少量AgNO3溶液,又有白色沉淀生成,再滴加少量稀HNO3,沉淀不消失
则:(1)溶液中一定存在的离子是 ,一定不存在的离子是 。
(2)能否判断原溶液中是否含有Cl- (“是” 或“否” ),其原因为 ;若要确定溶液中是否含有Cl-,其正确的操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质(Cl2、Br2等)相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
| | 卤素 | 氰 | 硫氰 | ① |
| “单质” | X2[ | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | HCN | ② | HOCN |
| 盐 | KX | KCN | KSCN | KOCN |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)填写下表
| 物质(杂质) | 除去杂质 所需试剂或方法 | 离子方程式 (若无离子方程式,则写化学方程式) |
| Fe(Al) | | |
| SiO2(CaCO3) | | |
| CO2(HCl) | | |
| NaHCO3溶液(Na2CO3) | | |
| Na2CO3(NaHCO3) | | |
| Al2O3(Al(OH)3) | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、 Fe2+、 Al3+,阴离子有Cl-、 OH-、CH3COO-、NO3-、SO42-、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。 请根据上述实验现象,写出下列六种化合物的化学式:
A ,B________,C ,D ,E ,F 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
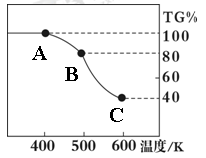
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
MnO2的一些性质或用途如图,下列说法正确的是 ( )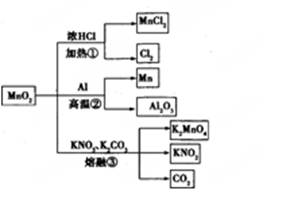
| A.①、②、③三个反应中MnO2均作氧化剂 |
| B.足量MnO2与2 L 10 mol/LHCl共热,可生成5 mol C12 |
| C.反应②若生成1 mol Al2O3,则反应过程中转移12 mol电子 |
| D.反应③中K2CO3和KNO3的化学计量数均为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是 ( )
| A.与NaOH反应的氯气一定为0.3 mol |
| B.n(Na+)∶n(Cl-)可能为7∶3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com