
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是 ( )
| A.与NaOH反应的氯气一定为0.3 mol |
| B.n(Na+)∶n(Cl-)可能为7∶3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1 |
C
解析试题分析:A、由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3)=0.03L×10mol/L=0.3mol,根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)=0.3mol,故参加反应的氯气n(Cl2)=0.15mol,故A错误; B、根据方程式 可知,氧化产物只有NaClO时,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3时,n(Na+):n(Cl-)最小为6:5,故6:5<n(Na+):n(Cl-)<2:1,7:3>2:1,故B错误; C、根据方程式
可知,氧化产物只有NaClO时,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3时,n(Na+):n(Cl-)最小为6:5,故6:5<n(Na+):n(Cl-)<2:1,7:3>2:1,故B错误; C、根据方程式 可知,氧化产物只有NaClO时,转移电子数最少,为
可知,氧化产物只有NaClO时,转移电子数最少,为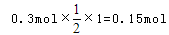 氧化产物只有NaClO3时,转移电子数最多,为
氧化产物只有NaClO3时,转移电子数最多,为 故C正确;D、令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D错误;
故C正确;D、令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D错误;
考点:考查氧化还原反应计算、根据方程式的计算等相关知识点


科目:高中化学 来源: 题型:填空题
中学常见的某反应的化学方程式为a+b→c+d+H2O(未配平,反应条件略去)。
请回答下列问题:
(1)若a是铁,b是稀硝酸(过量)且a可溶于c溶液中。则a与b反应的离子方程式为
(2)若c,d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪去,写出其褪色过程的离子方程式为
(3)若c是无色刺激性气味的气体,其水溶液显弱碱性,在标准状况下用排空气法收集c气体得平均摩尔质量为20g·mol-1的混合气体进行喷泉实验。假设溶质不扩散,实验完成后所得溶液的物质的量浓度为_ mol·L-1。(小数点后保留2位有效数字)
(4)若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5。则上述反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将等物质的量的铁和铜的混台物24 g与600mL稀硝酸恰好完全反应,生成NO6 .72 L(标准状况)向反应后的溶液中加入l mol·L-1 NaOH溶液使金属离于恰好沉淀,过滤。下列有关说法错误的是
| A.混合物溶解后的溶液中 c(Fe3+): c(Fe2+) =1:1 |
| B.需加入NaOH溶液1000mL |
| C.稀硝酸的物质的量浓度是2 mol·L-1 |
| D.最后所得沉淀在空气中充分加热可得固体32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+ 、Cl-和Co2+。下列叙述不正确的是
| A.氧化产物为Cl2 |
| B.氧化剂与还原剂的物质的量之比为1∶2 |
| C.若有3mol H2O生成,则反应中有2mol电子转移 |
| D.当该反应生成2.24L Cl2时,则反应中有0.1mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性溶液中可以发生反应产生Cl2,下列关于混盐CaOCl2的有关判断不正确的是(NA为阿伏加德罗常数)
| A.该混盐在酸性溶液中产生1mol Cl2时转移的电子数为NA |
| B.该混盐的水溶液具有漂白性 |
| C.该混盐中氯元素的化合价为+1和-1价 |
| D.该混盐具有较强的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金——氰化法提炼,即采用稀的NaCN溶液处理已粉碎的矿石,把少量的金浸入溶液中,然后用金属锌作还原剂将金从溶液中置换析出。其反应原理为
①4Au+8NaCN+O2+2H2O 4Na[Au(CN)2]+4NaOH;
4Na[Au(CN)2]+4NaOH;
②2Na[Au(CN)2]+Zn 2Au+Na2[Zn(CN)4]。
2Au+Na2[Zn(CN)4]。
以下有关氰化法提炼金的说法中正确的是( )
| A.Na[Au(CN)2]不溶于水 |
| B.化合物Na[Au(CN) 2]中金元素的化合价为+1 |
| C.金元素在地壳中能以化合态的形式存在 |
| D.在提炼过程中含金元素的物质始终作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O = 7Cu2S+5FeSO4+12H2SO4下列说法正确的是
| A.Cu2S既是氧化产物,又是还原产物 |
| B.产物中的SO42-有一部分是氧化产物 |
| C.5molFeS2发生反应时,有l0mol电子转移 |
| D.FeS2只做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用高铁酸钠(Na2FeO4)对河水、湖水消毒,是城市饮用水消毒的新技术。已知制备高铁酸钠的反应为Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是
| A.Na2O2既是氧化剂,又是还原剂 |
| B.Fe2O3在反应中得到电子 |
| C.3 mol Na2O2参加反应,转移的电子总数为12mol |
| D.Na2FeO4能消毒杀菌,因其具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是( )
| A.M | B.M2+ | C.M3+ | D.MO2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com