
【题目】已知A、B、C、D四种化合物均含有同种元素,该元素原子的电子层数是最外层电子数的3倍。E为单质,其组成元素的原子最外层电子数是电子层数的3倍。它们存在如图所示转化关系。
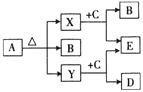
![]() 的化学式为________,除去A溶液中混有的B,可采用的方法是________________。
的化学式为________,除去A溶液中混有的B,可采用的方法是________________。
![]() 的电子式为________________,D的电子式为________________。
的电子式为________________,D的电子式为________________。
![]() 与C的反应中,氧化剂与还原剂的物质的量之比为________。
与C的反应中,氧化剂与还原剂的物质的量之比为________。
【答案】![]() 通入足量的
通入足量的![]()
![]()
![]()
![]()
【解析】
已知A、B、C、D四种化合物均含有同种元素,该元素原子的电子层数是最外层电子数的3倍,则该元素为Na元素。E为单质,其组成元素的原子最外层电子数是电子层数的3倍,则该元素为O,则E单质为O2;根据转化关系可以推测出A为NaHCO3,B为Na2CO3,C为Na2O2,D为NaOH,E为O2,X为CO2,Y为H2O,据此分析作答。
根据上述分析可知,
(1)A的化学式为NaHCO3;除去NaHCO3溶液中的Na2CO3可以向溶液中通入足量的CO2,足量的CO2与Na2CO3反应会生成NaHCO3;
故答案为:NaHCO3;向溶液中通入足量的CO2;
(2)X为CO2,碳氧之间为共价双键,则其电子式为:![]() ;D为NaOH,是离子化合物,则其电子式为:
;D为NaOH,是离子化合物,则其电子式为:![]() ;
;
故答案为: ![]() ;
;![]() ;
;
(3)CO2与Na2O2的反应中,2CO2+2Na2O2=2Na2CO3+O2,氧化剂和还原剂都是Na2O2,且物质的量之比为1:1,
故答案为:1:1。


科目:高中化学 来源: 题型:
【题目】利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为____________;
②常温下,不能与M单质发生反应的是____________(填序号);
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法已知:H2S(g)![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。根据图像回答下列问题:

i 计算 985 ℃时H2S按上述反应分解的平衡常数 K=________;
ii 说明随温度的升高,曲线b向曲线a逼近的原因:________________________________;
②电化学法

i该法制氢过程如图。反应池中反应物的流向采用气、液逆流方式,其目的是____________;
ii反应池中发生反应的化学方程式为____________;
iii反应后的溶液进入电解池,电解总反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,它们在周期表中位置如图所示,X的一种氢化物与其最高价氧化物对应水化物反应生成盐。下列说法正确的是
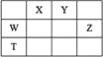
A. X的氢化物的沸点一定低于同主族元素形成的其他氢化物
B. 由Y、Z和氢三种元素形成的化合物中,Z的化合价越高氧化性越强
C. W的氧化物是酸性氧化物,能与碱、水反应,不能与酸反应
D. T元素单质具有半导体的特性,T与Y元素可形成两种化合物TY和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2 =5KCl+KClO3+3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺应在______________(填“温度较高”或“温度较低”)的情况下进行;
(2)在溶液I中加入KOH固体的目的是________(填编号)。
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为________________________________________ 。
(4)如何判断K2FeO4晶体已经洗涤干净________________________________。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期主族元素,其中仅含有一种金属元素,A单质试自然界中密度最小的气体,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成A2C和A2C2两种常见的液态化合物.请回答下列问题:
(1)A元素的名称是____,D在周期表中的位置______.E的离子结构示意图___.
(2)B2分子的电子式:__,A2C的结构式:______.
(3)用电子式表示D2E化合物的形成过程为__.
(4)用含A元素最简单的有机化合物与赤热的氧化铜反应生成一种单质、液态氧化物和一可以使澄清石灰水变浑浊的气体,其化学方程式为_______.
(5)在100mL 18mol/L E的最高价氧化物对应水化物的溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解.产生的气体在标准状况下的体积可能是____(填序号)
a.7.32L b.6.72L c.20.16L d.30.24L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示。下列选项中正确的是

选项 | 发生装置中的药品 | 干燥和集气装置 |
A | 亚硫酸钠和饱和稀盐酸 | 图2 |
B | 大理石和稀盐酸 | 图1 |
C | 铜和稀硝酸 | 图2 |
D | 氧化钙和浓氨水 | 图1 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Cu(NH3)4]SO4·H2O是一种重要的染料及合成农药中间体。 请回答下列问题:
(1)[Cu(NH3)4]2+在水溶液中的颜色是________。
(2)NH3中N原子的杂化轨道类型是________。
(3)Cu2+基态核外电子排布式为_________________。
(4)[Cu(NH3)4]SO4中存在的化学键类型除了极性共价键外,还有________。
(5)S、O、N三种元素的第一电离能由大到小的顺序为_____________。
(6)将金属铜投入到氨水和H2O2的混合溶液中,铜片溶解,溶液是深蓝色,其反应的离子方程式为________。
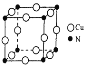
(7)铜氮合金的晶胞结构如图所示,该晶胞中距离最近的铜原子和氮原子核间的距离为![]() a pm,则该晶体的密度为________ g/cm3( 设NA为阿伏加德罗常数值)。
a pm,则该晶体的密度为________ g/cm3( 设NA为阿伏加德罗常数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于硅及硅的化合物的叙述中,正确的是( )
A.硅单质可以制光导纤维 和太阳能电池
B.硅是构成矿物和岩石的主要元素,其中硅酸钠俗称水玻璃
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中,是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙、丁四个烧杯中分别放入等物质的量的Na、Na2O、Na2O2、NaOH,然后各加入100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁里溶液的溶质质量分数大小的顺序是
A.甲<乙<丙<丁 B.丁<甲<乙=丙
C.甲=丁<乙=丙 D.丁<甲<乙<丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com