
����Ŀ��[Cu(NH3)4]SO4��H2O��һ����Ҫ��Ⱦ�ϼ��ϳ�ũҩ�м��塣 ��ش��������⣺
(1)[Cu(NH3)4]2+��ˮ��Һ�е���ɫ��________��
(2)NH3��Nԭ�ӵ��ӻ����������________��
(3)Cu2+��̬��������Ų�ʽΪ_________________��
(4)[Cu(NH3)4]SO4�д��ڵĻ�ѧ�����ͳ��˼��Թ��ۼ��⣬����________��
(5)S��O��N����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ_____________��
(6)������ͭͶ�뵽��ˮ��H2O2�Ļ����Һ�У�ͭƬ�ܽ⣬��Һ������ɫ���䷴Ӧ�����ӷ���ʽΪ________��
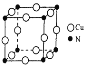
(7)ͭ���Ͻ�ľ����ṹ��ͼ��ʾ���þ����о��������ͭԭ�Ӻ͵�ԭ�Ӻ˼�ľ���Ϊ![]() a pm����þ�����ܶ�Ϊ________ g/cm3( ��NAΪ�����ӵ�����ֵ)��
a pm����þ�����ܶ�Ϊ________ g/cm3( ��NAΪ�����ӵ�����ֵ)��
���𰸡� ����ɫ sp3�ӻ� [Ar]3d9��1s22s22p63s23p63d9 ���Ӽ�����λ�� N>O>S Cu+H2O2+4NH3��H2O=[Cu(NH3)4]2++2OH-+4H2O ![]() ��1030
��1030
��������(1)[Cu(NH3)4]SO4 ��ˮ�д������½�����̣�[Cu(NH3)4]SO4�T[Cu(NH3)4]2+������ɫ���ӣ�+SO42����[Cu(NH3)4]2+=Cu2��+4NH3��(2)NH3������Nԭ�Ӽ۲���ӶԸ���=3+1/2����5-3��1��=4,�ж��ӻ����ͣ���5��ͬһ����Ԫ�صĵ�һ����������ԭ����������������������ƣ�����IIA�塢��VA��Ԫ�صĵ�һ�����ܴ�������Ԫ�صģ���6������ͭͶ�백ˮ��H2O2��Һ�о�����������Ͷ�백ˮ��H2O2�Ļ����Һ�У���ͭƬ�ܽ⣬��Һ������ɫ�����й�������Ϊ������������Cu2���γ������ӣ�������ٽ�ʹ��Ӧ���У�����������ԭ��Ӧ�е��ӵ�ʧ�غ�͵���غ���ƽ����7���þ����о��������ͭԭ�Ӻ͵�ԭ�Ӽ�ľ���Ϊ![]() apm�����Ծ����ı߳�Ϊ
apm�����Ծ����ı߳�Ϊ![]() apm���������Ϊ(
apm���������Ϊ(![]() apm��3�����þ�̯�����㾧���к��е�ͭԭ�Ӻ͵�ԭ�Ӹ��������ݦ�=m/V���㣮
apm��3�����þ�̯�����㾧���к��е�ͭԭ�Ӻ͵�ԭ�Ӹ��������ݦ�=m/V���㣮
(1)[Cu(NH3)4]2+��ˮ��Һ�е���ɫ������ɫ��(2)NH3������Nԭ�Ӽ۲���ӶԸ���=3+1/2����5-3��1��=4�Һ���һ���µ��Ӷԣ�����Nԭ�Ӳ���sp3�ӻ���NH3��Nԭ�ӵ��ӻ����������sp3�ӻ���(3)Cu2+��̬��������Ų�ʽΪ[Ar]3d9��1s22s22p63s23p63d9��(4)[Cu(NH3)4]SO4�д��ڵĻ�ѧ�����ͳ��˼��Թ��ۼ��⣬����[Cu(NH3)4]2+������ɫ���ӣ���SO42��֮������Ӽ���N��֮ͭ���ĵ���λ����(5)ͬ��������Ԫ�صĵ�һ�����ܣ�����ԭ����������������������ƣ�����VA����ڵ�VIA��Ԫ�أ�ͬ����Ԫ�أ�����ԭ�����������ӣ���һ��������С����S��O��N����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ��N��O��S��(6)����ͭͶ�백ˮ��H2O2��Һ�о�����������Ͷ�백ˮ��H2O2�Ļ����Һ�У���ͭƬ�ܽ⣬��Һ������ɫ�����й�������Ϊ������������Cu2���γ������ӣ�������ٽ�ʹ��Ӧ���У����ӷ���ʽ�ɱ�ʾΪ��Cu+H2O2+4NH3��H2O=[Cu(NH3)4]2++2OH-+4H2O��(7)�ھ����У�Nԭ��λ�ڶ��㣬Cuԭ��λ������е㣬�þ�����Nԭ�Ӹ���=8��1/8=1��Cuԭ�Ӹ���=12��1/4=3������������Ϊ(64��3+14)/NA g�����������Ϊ(![]() apm��3�����=
apm��3�����= =
=![]() ��1030g/cm3��
��1030g/cm3��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�[��ѧ����ѡ��5���л���ѧ����]
�����б��������������E�뻯����H��Cr-Ni���¿��Է���ż����Ӧ���ϳ�һ�ֶ�����ŵĻ�����Y����ϳ�·�����£�
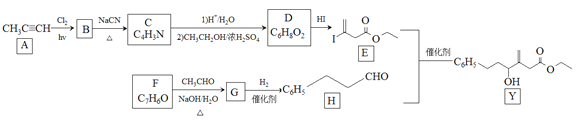
��֪��![]()
�ش��������⣺
��1��A�Ļ�ѧ������________________��
��2��BΪ���ȴ�������B����C�Ļ�ѧ����ʽΪ________________��
��3����A����B��G����H�ķ�Ӧ���ͷֱ���________________��________________��
��4��D�Ľṹ��ʽΪ________________��
��5��Y�к��������ŵ�����Ϊ________________��
��6��E��F��Cr-Ni����Ҳ���Է���ż����Ӧ������Ľṹ��ʽΪ________________��
��7��X��D��Ϊͬ���칹�壬�Ҿ�����ȫ��ͬ�����š�X�ĺ˴Ź���������ʾ���ֲ�ͬ��ѧ�������⣬������֮��Ϊ3��3��2��д��3�ַ�������������X�Ľṹ��ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����ʵ���Һ�������Ե��ǣ� ��
A.NaHCO3B.(NH4)2SO4C.CH3COONH4D.CH3COOK
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D���ֻ����������ͬ��Ԫ�أ���Ԫ��ԭ�ӵĵ��Ӳ�����������������3����EΪ���ʣ������Ԫ�ص�ԭ�������������ǵ��Ӳ�����3�������Ǵ�����ͼ��ʾת����ϵ��
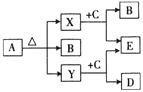
![]() �Ļ�ѧʽΪ________����ȥA��Һ�л��е�B���ɲ��õķ�����________________��
�Ļ�ѧʽΪ________����ȥA��Һ�л��е�B���ɲ��õķ�����________________��
![]() �ĵ���ʽΪ________________��D�ĵ���ʽΪ________________��
�ĵ���ʽΪ________________��D�ĵ���ʽΪ________________��
![]() ��C�ķ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ________��
��C�ķ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����32.64 gͭ��140 mLһ��Ũ�ȵ����ᷴӦ��ͭ��ȫ�ܽ������NO��NO2��������ڱ�״���µ����Ϊ11.2 L����ش�
(1)NO�����Ϊ________L(����һλ��Ч���֣���ͬ)��NO2�����Ϊ________L��
(2)�μӷ�Ӧ��HNO3�����ʵ�����___________��
(3)������������ȫ���ͷź�����Һ�м���V mL a mol��L1��NaOH��Һ��ǡ��ʹ��Һ�е�Cu2+ȫ��ת���ɳ�������ԭ������Һ��Ũ��Ϊ________mol��L1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȷ��ȡ 25.00mL KMnO4��Һ����ѡ�õ������� (���� )
A.25mL ��ͲB.25mL �ζ���
C.25mL ����ƿD.�п̶ȵ� 50mL �ձ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A. ��NaOH��Һ��ͨ�����SO2��SO2+2OH -��SO32 - +H2O
B. ���Ȼ�淋���Һ�м�������ŨNaOH��Һ�����ȣ�NH4++OH -![]() NH3��H2O
NH3��H2O
C. Ba(OH)2��Һ��H2SO4��Һ��ϲ���������Ba2++ SO4 2 -��BaSO4��
D. ������������ϡ���ᷴӦ�����ӷ���ʽ��3Fe+8H++2NO3-��4H2O+2NO��+3Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʣ����ᡢ��Ρ��ǵ���ʵ�˳�����е���
A. ���ᡢ�������Ȼ�þ��������̼ B. ���ᡢ�ռ�ɱ����մ�ˮ
C. ���ᡢ��ʯ�ҡ�������ͭ D. �Ȼ��⡢�����ơ�NaHCO3������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��R��X��Y��Z��ԭ���������ε�����R����������Һ���ڲ��������Ͽ̱����R��X���γ�XR3�ͻ����X�ڻ�������ֻ��һ�ֻ��ϼ���R��Zλ��ͬ���壬Yԭ���������������ڵ��Ӳ�����2���������й��ƶ���ȷ����
A. R���ʺ�Z���ʾ�����ˮ������Ӧ�û���O2
B. ����Ԫ���γɵļ����Ӷ��ܴٽ�ˮ�ĵ���ƽ��
C. YR6���������о���ȼ��
D. Ԫ�ض�Ӧ�ļ����ӵİ뾶:Y>Z>R>X
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com