
����Ŀ��������أ�K2FeO4����һ�ּ�������������������һ������Ͷ��ˮ���������������������£�

��֪����2KOH��Cl2��KCl��KClO��H2O���������¶Ƚϵͣ�
��6KOH��3Cl2 ��5KCl��KClO3��3H2O���������¶Ƚϸߣ�
�ش��������⣺
(1)����������Ӧ��______________�������¶Ƚϸ��������¶Ƚϵ�����������½��У�
(2)����ҺI�м���KOH�����Ŀ����________�����ţ���
A������ҺI�й�����Cl2������Ӧ�����ɸ����KClO
B��KOH�����ܽ�ʱ��ų��϶����������������߷�Ӧ����
C��Ϊ��һ����Ӧ�ṩ���ԵĻ���
D��ʹKClO3ת��Ϊ KClO
(3)����ҺII�з����K2FeO4�����и���ƷKNO3��KCl����Ӧ���з��������ӷ�Ӧ����ʽΪ________________________________________ ��
(4)����ж�K2FeO4�����Ѿ�ϴ�Ӹɾ�________________________________��
(5)������أ�K2FeO4����Ϊˮ��������һ���ŵ�������ˮ��Ӧ���ɽ����������ʣ���ƽ�÷�Ӧ�����ӷ���ʽ��_____________________________________________��
���𰸡��¶Ƚϵ�AC2Fe3+ + 3ClO�� + 10OH�� �� 2FeO42- + 3Cl��+ 5H2O���Թ�ȡ�������һ�ε�ϴ��Һ��������������Һ���ް�ɫ�������ѱ�ϴ��4FeO42- + 10H2O == 4Fe(OH)3�����壩+ 3O2�� + 8OH��
��������
����������Һ�г����������������¶Ƚϵ͵������·�Ӧ�����Ȼ��ء�������غ�ˮ�������������ع����ȥKCl���õ�����KClO��Ũ��Һ������90%��������Һ������Ӧ���ɸ��������Һ���õ�ʪ��Ʒ��ϴ�Ӹ���õ�K2FeO4���壬�Դ˽��
��1���ɹ������̼��ۿ�֪��������������KClO�Ʊ�������أ�����Ϣ�ڿ�֪�¶Ƚϸ�KOH��������Ӧ���ɵ�������ء�����Ϣ�ٿ�֪���ڵ�����KOH��������Ӧ���ɵ���KClO����ѡ���¶Ƚϵͣ�
��ˣ�������ȷ�������¶Ƚϵͣ�
��2���ɹ������̿�֪����ӦҺI���й�����������Ӧ����KOH�����Ŀ���������������������Ӧ�����ɸ����KClO��
A.�����������������Ӧ�����ɸ����KClO����A��ȷ��
B.����Ϣ�ڿ�֪�¶Ƚϸ�KOH��������Ӧ���ɵ�������أ�������KClO���ɡ��˷�ԭ�ϣ���B����
C.�ɹ������̼��ۿ�֪��������������KClO�Ʊ�������أ���C��ȷ��
D.����Ϣ��֪�������������������ת��ΪKClO����D����
��ѡA��C��
��ˣ�������ȷ������AC��
��3������Ŀ��Ϣ��������ԭ��Ӧ�л��ϼ۷����仯ȷ���ҳ���Ӧ�Fe3+��ClO-�������FeO42-��Cl-�����ݵ��ӵ�ʧ�غ�������غ�����ƽ����Ӧ���з��������ӷ�Ӧ����ʽΪ2Fe3+ + 3ClO�� + 10OH�� �� 2 FeO42-+ 3Cl��+ 5H2O��
��ˣ�������ȷ������2Fe3+ + 3ClO�� + 10OH�� ��2FeO42- + 3Cl��+ 5H2O��
��4����ֻҪ�������һ�ε�ϴ������Cl-������֤��K2FeO4�����Ѿ�ϴ�Ӹɾ���
�ʴ�Ϊ�����Թ�ȡ�������һ�ε�ϴ��Һ��������������Һ���ް�ɫ�������ѱ�ϴ����
��5��������أ�K2FeO4����ˮ��Ӧʱ�����������������������������ʣ���Ԫ�ر���ԭ�����ж���������ΪO2,���ݵ��ӵ�ʧ�غ�������غ�����ƽ���ɵ�4FeO42- + 10H2O = 4Fe(OH)3�����壩+ 3O2�� + 8OH����
��ˣ�������ȷ������4FeO42- + 10H2O = 4Fe(OH)3�����壩+ 3O2�� + 8OH����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʷ���������У�����ȷ����
A.����������B.Һ�����ڴ�����
C.̼�������ڼ�D.������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ������ȷ����
A. TNT�Ľṹ��ʽ��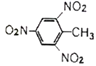 B. �����ǵ�ʵ��ʽ��C6H12O6
B. �����ǵ�ʵ��ʽ��C6H12O6
C. ��ȩ�ĵ���ʽ��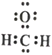 D. ����Ľṹʽ��C2H4O2
D. ����Ľṹʽ��C2H4O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ͬ���칹���������ȷ����
A. ![]() �����ϵ�һ��ȡ������5��
�����ϵ�һ��ȡ������5��
B. ���飨C4H10���Ķ���ȡ���������4��
C. �ƵĽṹ��ʽΪ ����һ����ȡ������10��
����һ����ȡ������10��
D.  ��
�� ��Ϊͬ���칹��
��Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����ʵ���Һ�������Ե��ǣ� ��
A.NaHCO3B.(NH4)2SO4C.CH3COONH4D.CH3COOK
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ��(Pb3O4)����������Ϳ�ϣ���֪Ǧ����PbԪ�صĻ��ϼ�ֻ��+2��+4����+2���ȶ���+4�۵�Pb����ǿ�����ԣ�������Ũ��������Cl2��������˵������ȷ���� (����)
A. Pb3O4�ɱ�ʾΪ2PbO��PbO2
B. ����PbO�ڿ����м����Ʊ�Ǧ������n����������:n����ԭ����=1:6
C. 0.1mol Pb3O4��������Ũ���ᷴӦ������Cl20.1 mol
D. a mol Pb3O4��ǿ�ȷֽ�����PbO������ȹ�����ת�Ƶ�����Ϊ2a NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D���ֻ����������ͬ��Ԫ�أ���Ԫ��ԭ�ӵĵ��Ӳ�����������������3����EΪ���ʣ������Ԫ�ص�ԭ�������������ǵ��Ӳ�����3�������Ǵ�����ͼ��ʾת����ϵ��
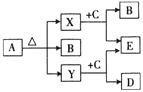
![]() �Ļ�ѧʽΪ________����ȥA��Һ�л��е�B���ɲ��õķ�����________________��
�Ļ�ѧʽΪ________����ȥA��Һ�л��е�B���ɲ��õķ�����________________��
![]() �ĵ���ʽΪ________________��D�ĵ���ʽΪ________________��
�ĵ���ʽΪ________________��D�ĵ���ʽΪ________________��
![]() ��C�ķ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ________��
��C�ķ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȷ��ȡ 25.00mL KMnO4��Һ����ѡ�õ������� (���� )
A.25mL ��ͲB.25mL �ζ���
C.25mL ����ƿD.�п̶ȵ� 50mL �ձ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����һ��������п��Ͷ��100mL 18.5mol/L��Ũ�����У���п����ȫ�ܽ������ɵ�H2��SO2��33.6L����״��������ʱ��Һ������0.1mol H+�������֪��
��Ͷ��п��������Ϊ_____________g��
�����ɵ�H2��SO2�����ʵ���֮��Ϊ_____________��
��2��ȡ25.6 g Cu��һ������ijŨ�ȵ�ŨHNO3��Ӧ����ͭ��ȫ�ܽ���ռ���������NO��NO2��������ڱ�״���µ������11.2 L����
��������������ʵ���Ϊ_____________mol��
��NO�����ʵ���Ϊ_____________mol��NO2�����ʵ���Ϊ_____________mol��
�۵�ͭ��ȫ�ܽ�ʱ����Ӧ��ת�Ƶĵ�����ĿΪ_____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com