
【题目】下列化学用语正确的是
A. TNT的结构简式: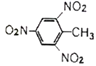 B. 葡萄糖的实验式:C6H12O6
B. 葡萄糖的实验式:C6H12O6
C. 甲醛的电子式: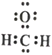 D. 乙酸的结构式:C2H4O2
D. 乙酸的结构式:C2H4O2
科目:高中化学 来源: 题型:
【题目】硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:_______
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。

①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至____后,迅速关闭K1,观察到U形管内的现象是______。
②装置Ⅲ中发生反应的化学方程式为__________。
③蘸NaOH溶液的棉花团的作用是____________。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为____________;
②常温下,不能与M单质发生反应的是____________(填序号);
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法已知:H2S(g)![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。根据图像回答下列问题:

i 计算 985 ℃时H2S按上述反应分解的平衡常数 K=________;
ii 说明随温度的升高,曲线b向曲线a逼近的原因:________________________________;
②电化学法

i该法制氢过程如图。反应池中反应物的流向采用气、液逆流方式,其目的是____________;
ii反应池中发生反应的化学方程式为____________;
iii反应后的溶液进入电解池,电解总反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年4月,美国公布301征税建议清单,对包括铜、锌等贱金属及其制品在内的1300种中国商品加征高达25%的关税,请回答下列有关锌、铜及其化合物的问题:
(1)写出基态Zn原子的外围电子排布式__________________。
(2)新型农药松脂酸铜具有低残留的特点,下图1是松脂酸铜的结构简式:

松脂酸铜结构中π键的个数为___________;加“*”碳原子的杂化方式为________________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,类卤素(SCN)2对应的酸有两种,硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是________________________________。
(4)工业上在用黄铜矿冶炼铜时会产生副品SO2,SO2分子的几何构型为____________,比较第一电离能:S__________O(填“>”“=”或“<”)
(5)ZnS的晶胞结构如下图2所示,在ZnS晶胞中,与每个Zn2+最近且等距离的Zn2+有______个。
(6)铜与金形成的金属互化物结构如下图3,晶胞边长为anm,该金属互化物的密度为__________ g·cm-3(用含“a、NA的代数式”表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2。
查阅资料:SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,极易水解,遇潮湿空气会产生白雾。
(1)化合物SO2Cl2中S元素的化合价是__________。
(2)实验室中制备氯气时为得到干燥纯净的氯气,应将气体依次通过盛有_______和_______的洗气瓶。
(3)用如图所示装置制备SO2Cl2。

①B中冷凝水从__________ (填“m”或“n”)口进入。
②C中的药品是______。目的一是吸收外界空气中的水蒸气,目的二是:_______________。
③向A所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子(除OH-外)只有SO42-、Cl-,写出SO2Cl2与H2O反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两种有机物的结构简式如下图所示,下列说法正确的是

A. 甲和乙均可以和氢氧化钠溶液反应
B. 有机物乙存在顺反异构
C. 乙分子中所有的碳原子一定在同一平面上
D. 甲和乙均能与溴水发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,它们在周期表中位置如图所示,X的一种氢化物与其最高价氧化物对应水化物反应生成盐。下列说法正确的是
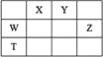
A. X的氢化物的沸点一定低于同主族元素形成的其他氢化物
B. 由Y、Z和氢三种元素形成的化合物中,Z的化合价越高氧化性越强
C. W的氧化物是酸性氧化物,能与碱、水反应,不能与酸反应
D. T元素单质具有半导体的特性,T与Y元素可形成两种化合物TY和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2 =5KCl+KClO3+3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺应在______________(填“温度较高”或“温度较低”)的情况下进行;
(2)在溶液I中加入KOH固体的目的是________(填编号)。
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为________________________________________ 。
(4)如何判断K2FeO4晶体已经洗涤干净________________________________。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于硅及硅的化合物的叙述中,正确的是( )
A.硅单质可以制光导纤维 和太阳能电池
B.硅是构成矿物和岩石的主要元素,其中硅酸钠俗称水玻璃
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中,是重要的半导体材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com