
【题目】2018年4月,美国公布301征税建议清单,对包括铜、锌等贱金属及其制品在内的1300种中国商品加征高达25%的关税,请回答下列有关锌、铜及其化合物的问题:
(1)写出基态Zn原子的外围电子排布式__________________。
(2)新型农药松脂酸铜具有低残留的特点,下图1是松脂酸铜的结构简式:

松脂酸铜结构中π键的个数为___________;加“*”碳原子的杂化方式为________________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,类卤素(SCN)2对应的酸有两种,硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是________________________________。
(4)工业上在用黄铜矿冶炼铜时会产生副品SO2,SO2分子的几何构型为____________,比较第一电离能:S__________O(填“>”“=”或“<”)
(5)ZnS的晶胞结构如下图2所示,在ZnS晶胞中,与每个Zn2+最近且等距离的Zn2+有______个。
(6)铜与金形成的金属互化物结构如下图3,晶胞边长为anm,该金属互化物的密度为__________ g·cm-3(用含“a、NA的代数式”表示)。

【答案】 3d104s2 6 sp3 异硫氰酸分子间可形成氢键,而硫氰酸不能 折线形(V形或角形) < 12 ![]()
【解析】(1)Zn原子核外电子数为30,根据能量最低原理书写外围电子排布式;
(2)单键为σ键,双键含有1个σ键、1个π键;加“*”碳原子形成4个σ键,没有孤对电子,杂化轨道数目为4;
(3)异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键
(4)SO2分子中S原子孤对电子数为![]() =1、价层电子对数=2+1=3,同主族自上而下第一电离能减小.
=1、价层电子对数=2+1=3,同主族自上而下第一电离能减小.
(5)与每个Zn2+最近且等距离的Zn2+分布在立方体的面心上,每个Zn2+被8个立方体共用,有12个面与之相连.
(6)根据均摊法计算出晶胞中Cu、Au原子数,根据ρ=![]() 计算密度.
计算密度.
(1) Zn原子核外电子数为30,根据能量最低原理,外围电子排布式为:3d104s2;答案为:3d104s2
(2)1个松脂酸铜中含有6个双键,则含有6个π键,加“”碳原子形成4个σ键,没有孤对电子,杂化轨道数目为4,采取sp3杂化,故答案为:6;sp3
(3)由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸,故答案为:异硫氰酸分子间可形成氢键,而硫氰酸不能
(4)S原子孤对电子数为![]() =1、价层电子对数=2+1=3,故其空间结构为折线形(V形或角形),同主族自上而下第一电离能减小,则第一电离能S<O,故答案为:折线形(V形或角形);<.
=1、价层电子对数=2+1=3,故其空间结构为折线形(V形或角形),同主族自上而下第一电离能减小,则第一电离能S<O,故答案为:折线形(V形或角形);<.
(5)根据晶胞的结构可知,以晶胞中顶点上的Zn2+为研究对象,与它距离最近等距离的Zn2+分布在立方体的面心上,每个Zn2+被8个立方体共用,有12个面与之相连,所以每个Zn2+周围与它距离最近等距离的Zn2+有12个,答案为:12
(6)Cu原子位于晶胞面心,数目为6×![]() =3,Au原子为晶胞顶点,数目为8×
=3,Au原子为晶胞顶点,数目为8×![]()
=1,晶胞体积V=(a×10-7)3,密度ρ=![]() =
= ![]() ,答案为:
,答案为:![]()


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
【题目】为达到预期的实验目的,下列操作中正确的是( )
A.用玻璃棒蘸取待测液滴在润湿的pH试纸上,测得其pH为12
B.用待测液润洗滴定用的锥形瓶
C.中和热测定的实验中使用的玻璃仪器只有3种
D.在滴定时,左手操作锥形瓶,右手操作滴定管开关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。下列有关“At”“Ga”“Ce”“F”等元素的说法错误的是
A. 砹(At)属于过渡元素
B. 门捷列夫预言的“类铝”—镓(Ga)元素的发现,证实了元素周期律的科学性
C. ![]() 原子核内的中子数为82
原子核内的中子数为82
D. 第ⅡA族的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
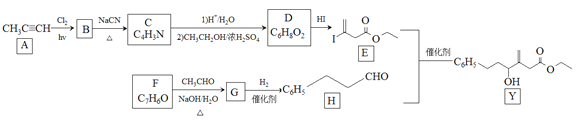
已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成环反应在有机合成中具有重要应用,某环状化合物G的合成过程如下:

(1)A→B为加成反应,则B的结构简式是______;B→C的反应类型是______.
(2)G中含有的官能团名称是______;F的化学式为______.
(3)D→E的化学方程式是___________________________________________.
(4)H是F的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(CH3O—).H的结构简式是________________.
(5)由C通过加聚反应合成的高分子化合物M的化学方程式为______.
(6)下列说法正确的是______.
A.A能和HCl反应得到聚氯乙烯的单体
B.1mol G完全燃烧生成8mol H2O
C.F能发生加成反应、取代反应、氧化反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述正确的是
A. ![]() 苯环上的一氯取代物有5种
苯环上的一氯取代物有5种
B. 丁烷(C4H10)的二氯取代物最多有4种
C. 菲的结构简式为 ,其一硝基取代物有10种
,其一硝基取代物有10种
D.  和
和 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确量取 25.00mL KMnO4溶液,可选用的仪器是 ( )
A.25mL 量筒B.25mL 滴定管
C.25mL 容量瓶D.有刻度的 50mL 烧杯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com