
| m |
| M |
| n |
| V |
| 溶质质量 |
| 溶液质量 |
| 1 |
| 10 |
| 24.4g |
| 40g/mol |
| 0.61mol |
| 0.1L |
| 24.4g |
| 122g |
| 1 |
| 10 |
| 1 |
| 10 |
| 1 |
| 10 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | n- 3 |
| O | n- 3 |
| O | n- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
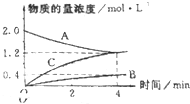 如图,曲线表示在800℃时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答:
如图,曲线表示在800℃时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 |
| 燃烧热(kJ?mol-1) | 890 | 1 560 | 2 220 | 2 880 |
| A、C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=-3 540 kJ?mol-1 |
| B、C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=-3 540 kJ?mol-1 |
| C、C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=+3 540 kJ?mol-1 |
| D、C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=+3 540 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、CO32-、SO42- |
| B、Fe2+、NO3-、H+ |
| C、NH4+、Cl-、HCO3- |
| D、K+、H+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L Cl2与热碱溶液完全反应生成Cl-和ClO3-转移了0.1NA e- |
| B、已知S-S键的键能为265kJ/mol,若使1mol某硫单质(气态)全部形成气态硫原子需要2120kJ能量,则3.2g这种硫单质中含S-S键的数目为0.1NA |
| C、0.1mol/L的FeBr3溶液中含0.3NA Br- |
| D、已知25℃,101kPa时气体摩尔体积为24.5L/mol.则此条件下0.05NA Fe与足量盐酸反应,产生H2约为1.225L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com