
| O | n- 3 |
| O | n- 3 |
| O | n- 3 |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
A、中子数为8的N原子:
| ||
B、硫离子的结构示意图: | ||
| C、H2O2的结构式:H-O-O-H | ||
| D、石英的化学式:Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 决定物质性质的重要因素是物质的结构.请回答下列问题:
决定物质性质的重要因素是物质的结构.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
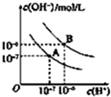 (1)写出下列物质溶于水的电离方程式
(1)写出下列物质溶于水的电离方程式查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠投入到乙醇中 |
| B、红热的木炭投入到热的浓硝酸中 |
| C、电石投入到水中CaC2 |
| D、加热溴乙烷与NaOH乙醇溶液的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1+Q2=a |
| B、Q1+2Q2<2a |
| C、Q1+2Q2>2a |
| D、Q1+Q2<a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com