
����Ŀ��ij�¶��£���2L�ܱ������г���4molA�����3molB���壬�������з�Ӧ��2A(g)+B(g)![]() C(g)+xD(g)��5s�ﵽƽ�⡣�ﵽƽ��ʱ��������1molC���ⶨD��Ũ��Ϊ1mol/L��
C(g)+xD(g)��5s�ﵽƽ�⡣�ﵽƽ��ʱ��������1molC���ⶨD��Ũ��Ϊ1mol/L��
(1)��x=__��
(2)����������˵��������Ӧ�ﵽƽ��״̬����__��
A����λʱ����ÿ����2molA��ͬʱ����1molC
B����λʱ����ÿ����1molB��ͬʱ����1molC
C��D������������ٱ仯
D����������ѹǿ���ٱ仯
E��B��C��Ũ��֮��Ϊ1��1
���𰸡�2 BC
��������
������=![]() ����v(D)���㷴Ӧ������D�����ʵ�������Ϸ�Ӧ������C��D�����ʵ����ı���1��x������x��ֵ���÷�Ӧ�Ƿ�Ӧǰ�����������ȵķ�Ӧ�����ݷ�Ӧ�ﵽƽ��ʱ�������ʵ����ʵ���Ũ�Ȳ��䣬���ʵĺ������䣬�����淴Ӧ��������ж�ƽ��״̬��Ȼ�������
����v(D)���㷴Ӧ������D�����ʵ�������Ϸ�Ӧ������C��D�����ʵ����ı���1��x������x��ֵ���÷�Ӧ�Ƿ�Ӧǰ�����������ȵķ�Ӧ�����ݷ�Ӧ�ﵽƽ��ʱ�������ʵ����ʵ���Ũ�Ȳ��䣬���ʵĺ������䣬�����淴Ӧ��������ж�ƽ��״̬��Ȼ�������
(1)������=![]() ����c(D)= 1 mol��L-1����Ӧ����Ϊ2 L����n(D)=cV=1 mol��L-1��2 L=2 mol��CΪ�����5sʱn(C)=1mol����n(C)����n(D)=1��2=1��x����x=2��
����c(D)= 1 mol��L-1����Ӧ����Ϊ2 L����n(D)=cV=1 mol��L-1��2 L=2 mol��CΪ�����5sʱn(C)=1mol����n(C)����n(D)=1��2=1��x����x=2��
(2) A�����ݷ�Ӧ����ʽ��֪����λʱ����ÿ����2 mol A��ͬʱ����1 mol C������ʾ��������Ӧ���ʣ����ܾݴ��жϷ�Ӧ�Ƿ���ƽ��״̬��A����
B����λʱ����ÿ����1 mol B���ͱ�Ȼ��ͬʱ����1 molC���ʣ�����1 mol C����˵����B��ʾ�Ļ�ѧ��Ӧ����v(��)=v(��)����Ӧ����ƽ��״̬��B��ȷ��
C�����ŷ�Ӧ���У�D�������������������ij��ʱ��D������������ٱ仯��˵����Ӧ�ﵽƽ�⣬C��ȷ��
D�����ڷ�Ӧ2A(g)+B(g)![]() C(g)+2D(g)��Ϊ��Ӧǰ�����������Ŀ����ķ�Ӧ�����۷�Ӧ���е�ʲô�̶ȣ���Ӧ��������ѹǿʼ�ղ��䣬��˲��ܾݴ��жϷ�Ӧ�Ƿ���ƽ��״̬��D����
C(g)+2D(g)��Ϊ��Ӧǰ�����������Ŀ����ķ�Ӧ�����۷�Ӧ���е�ʲô�̶ȣ���Ӧ��������ѹǿʼ�ղ��䣬��˲��ܾݴ��жϷ�Ӧ�Ƿ���ƽ��״̬��D����
E��B��C��Ũ��֮��Ϊ1��1ʱ��Ӧ���ܴ���ƽ��״̬��Ҳ����δ�ﵽƽ��״̬����˲��ܾݴ��жϷ�Ӧ�Ƿ���ƽ��״̬��E����
�ʷ����������BC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ⱥ����ܱ�������ͨ��![]() ��
��![]() ��һ��������ʹ��Ӧ
��һ��������ʹ��Ӧ![]() �ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ��ʾ
�ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ��ʾ![]() ��ͼ�ó��Ľ��۲���ȷ����
��ͼ�ó��Ľ��۲���ȷ����
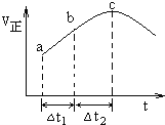
A. ��Ӧ������ѹǿʼ�ղ���
B. ��Ӧ��Ũ�ȣ�a�����b��
C. ��Ӧ��������������������������
D. ![]() ʱ��
ʱ��![]() ��ת���ʣ�
��ת���ʣ�![]() ��С��
����![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����־��в�ͬ�����ķ��Ӱٷ����������Ķ�Ӧ��ϵͼ������һ���¶��·��������ֲ�����ͼ��ͼ��E��ʾ����ƽ��������Ec�ǻ���Ӿ��е��������������˵������ȷ���ǣ� ��
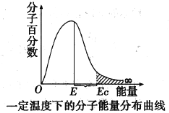
A.ͼ��Ec��E֮���ʾ���
B.�����¶ȣ�ͼ����Ӱ�������������
C.ʹ�ú��ʵĴ�����E���䣬Ec��С
D.��������Ec�ķ��Ӽ䷢������ײһ������Ч��ײ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͼ�п�̵�غ���п����Ԫ�أ���Ҫ����ZnO��ZnMn2 O4��MnO��Mn2 O3��Mn3 O4��MnO2�����÷Ͼ�п�̵�ػ���п���Ʊ��������̡�����Ĺ���������ͼ��
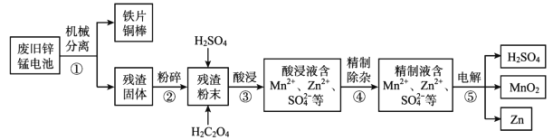
�ش��������⣺
(1)�����������������ҪĿ����______��
(2)������������������һϵ�з�Ӧ��
ZnO+ H2SO4= ZnSO4 + H2O��MnO+ H2SO4= MnSO4 + H2O��
ZnMn2O4+2H2SO4=ZnSO4 + MnSO4 +2H2O+MnO2��
MnO2 + H2SO4 + H2C2O4=MnSO4 + 2CO2 ��+2H2O��
�Ʋ� Mn2O3 �����ᷴӦ�����ӷ���ʽΪ______��
(3)��ͼ�ֱ��ʾ�������ʱѡ�ò�ͬŨ������Ͳ���� Zn��Mn �����ʵ�Ӱ�졣
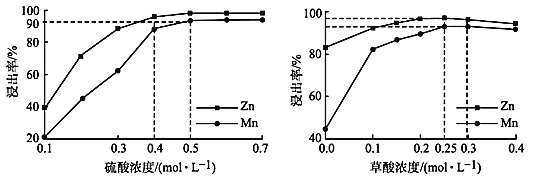
��Ϊ��֤ Zn��Mn �Ľ����ʾ����� 90%�����������Ƶ� c(H2SO4) = ____mol/L��H2C2O4 Ũ�ȶ� Mn �Ľ�����Ӱ��̶ȴ��� Zn����ԭ����_____��
�ڼ����������������Һ��Zn2+��Mn2+Ũ����ȡ��� c(H2C2O4)>0.25 mol/L ʱ��Zn��Mn �Ľ����ʷ����½�����Zn �Ľ������½�����Mn����ԭ�������_____(�����)��
a.���ŷ�Ӧ���� c(H+)����
b.Zn2+��Mn2+�� C2O42- ���ɳ���
c.�ܽ�ȣ�ZnC2O4��MnC2O4
(4)������ö��Ե缫��� ZnSO4 ��MnSO4 �Ļ����Һ�������� Zn��MnO2��H2SO4 �⣬ ���������� H2��O2 �������
������ MnO2 �ĵ缫��ӦʽΪ_____ ��
���� n (H2) ��n (O2)=2��1����μӷ�Ӧ�� n (Zn2+)��n (Mn2+) = ______��
�۸ù��������п�ѭ�����õ�������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A��B���ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)+B(g) 2C(g)+2D(g)����Ӧ���е�10sĩ�����A�����ʵ���Ϊ1.8mol��B�����ʵ���Ϊ0.6mol��C�����ʵ���Ϊ0.8mol����
(1)��C��ʾ10s�ڷ�Ӧ��ƽ����Ӧ����Ϊ__��
(2)10sĩ��������D��Ũ��Ϊ__��
(3)���ı���������������D��������α仯(��������������С���������������)��
��� | �ı������ | ����D������ |
�� | �����¶� | ___ |
�� | ����A��Ũ�� | ___ |
�� | ʹ�������� | ___ |
�� | �����³���Ne (��������ϵ��Ӧ) | ___ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ�������������ת����˵����ȷ���ǣ� ��
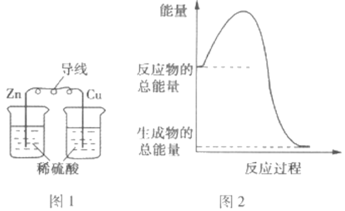
A.ͼ1��ʾ��װ���ܽ���ѧ��ת��Ϊ����
B.ͼ2��ʾ�ķ�ӦΪ���ȷ�Ӧ
C.�кͷ�Ӧ�У���Ӧ��������������������������
D.��ѧ��Ӧ�������仯�ĸ���ԭ���ǻ�ѧ���Ķ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L�������У��ô�����CaCO3��100mLϡ���ᷴӦ��ȡCO2����Ӧ����CO2�������ʱ��ı仯��ϵ��ͼ��ʾ��CO2�����������Ϊ��״���µ����)�����з�����ȷ���ǣ� ��

A.OE�α�ʾ��ƽ����Ӧ�������
B.F���ռ�����CO2�������
C.EF�Σ��������ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ0.4mol��L-1��min-1
D.OE��EF��FG�����У��÷�Ӧ�ö�����̼��ʾ��ƽ����Ӧ����֮��Ϊ2��6��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�������������ı仯��ij��ѧ��Ӧ���������仯��ͼ��ʾ���û�ѧ��Ӧ������
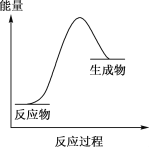
A.NaOH+HCl=NaCl+H2O
B.Fe+H2SO4=FeSO4+H2��
C.2Na2O2+2H2O=4NaOH+O2��
D.Ba(OH)2��8H2O+2NH4Cl=BaCl2+2NH3��+10H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�����˵����ȷ����
A. ��ϵͳ������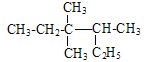 ������Ϊ3��3-����-2-�һ�����
������Ϊ3��3-����-2-�һ�����
B. ��һ�������£����ᡢ�������ᡢ�����ʾ�����NaOH������Ӧ
C. ����ʽΪC5H12O�Ĵ�����8 �֣������ܴ�������ȩ��ͬ���칹����3 ��
D. ����ϩ( PE)�;�����ϩ( PVC)�ĵ��嶼�Dz�����������Щ�������ʹ��ˮ��ɫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com