
【题目】a mol FeS与b mol FeO投入V L c mol·L-1的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为( )
A.62(a+b) gB.186(a+b) gC.![]() molD.
molD.![]() mol
mol
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】实验室回收废水中苯酚的过程如图所示。下列分析错误的是( )
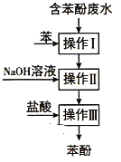
A. 操作Ⅰ中苯作萃取剂,多次萃取后检验是否萃取干净可选择三氯化铁溶液
B. 苯酚钠是离子化合物,在苯中的溶解度比在水中的小
C. 通过操作Ⅱ苯可循环使用, 三步操作均需要分液漏斗,
D. 操作中苯酚碰到皮肤,需用NaOH溶液清洗后,再用大量水不断冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烷烃的表述正确的是( )
A.乙烷的结构式为CH3CH3
B.C5H12分子的某种结构为CH3CH2(CH3)CH2CH3
C.CH3CH2CH(C2H5)CH2CH2CH3与CH3CH2CH2CH(C2H5)CH2CH3互为同分异构体
D.C4H10的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应不能实砚如下图所示转化的是
选项 | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(部分夹持装置略)、试剂和操作方法都正确的是 ( )
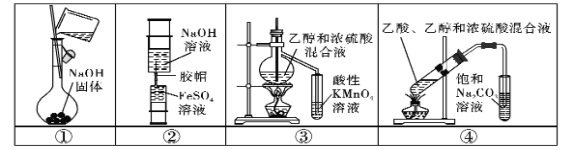
A.用装置①配制250 mL0.1 mol.L-1的NaOH溶液
B.用装置②制备少量Fe(OH)2固体
C.用装置③验证乙烯的生成
D.用装置④制取少量乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为九种主族元素在周期表中的位置:
A | |||||||
E | F | ||||||
B | D | I | G | ||||
C | H | ||||||
请回答下列问题:
(1)I元素的位置是第________周期,第______族。
(2)C、B、D 三种元素的金属性由强到弱的顺序为_______(填元素符号)。
(3)E、F两种元素对应的最简单氢化物的稳定性:________________ (填化学式)。
(4)C的单质与水反应的离子方程式为_______。
(5)用电子式表示A和G形成化合物的过程:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。
(1)基态硼原子的价电子轨道表达式是________。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为______。
(2)晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的____。
(3)B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
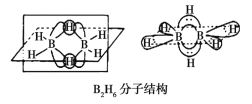
①B2H6分子结构如图,则B原子的杂化方式为__________
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是__________,写出一种与氨硼烷互为等电子体的分子_________(填化学式)。
(4)以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂。BH4-的立体构型为__________________。
(5)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。
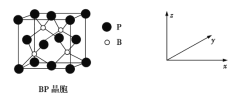
磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有毒气体。请回答下列问题:
(1)Q的离子结构示意图是__________________。
(2)六种元素中,原子半径最大的是___________。(写元素符号)
(3)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)____________。
(4)Y和Z的气态氢化物中,热稳定性强的是________(用物质化学式表示)。
(5)Y的气态氢化物与X和M形成的化合物反应,产物的化学式为________,其中存在的化学键类型为____________________。
(6)X与Z可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:_______________________________________________________________。
(7)单质M与水反应的离子方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年科学家们合成了具有半导体特性的环状C18分子,其合成方法的示意图如下:
C24O6![]() C22O4
C22O4![]() C20O2
C20O2![]() C18
C18
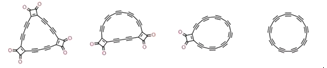
下列说法不正确的是
A.C与O同属第二周期元素,原子半径C>O
B.非金属性C<O,故C24O6中O显负价
C.C22O4分子中含有极性键和非极性键
D.C18与C60、金刚石互为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com