

 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫酸是实验室常用的一种化学试剂,某硫酸试剂瓶上标签的部分内容如图所示.
硫酸是实验室常用的一种化学试剂,某硫酸试剂瓶上标签的部分内容如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
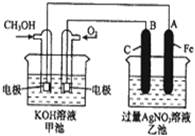
查看答案和解析>>
科目:高中化学 来源: 题型:
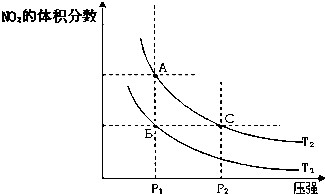
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、顺丁橡胶耐磨性、弹性、耐低温和耐热性都好 |
| B、顺丁橡胶的耐热性好 |
| C、顺丁橡胶的柔韧性好 |
| D、顺丁橡胶的吸水性好 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a>b | B、a<b |
| C、a=b | D、无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com