
【题目】邻硝基甲苯和对硝基甲苯能被用作爆炸品检测的示踪剂。某探究小组利用下图反应和装置制备一硝基甲苯。
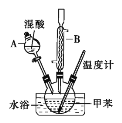
实验中可能用到的数据:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:
①按体积比1∶3配制浓硫酸与浓硝酸的混合物80mL;②在250mL的三颈烧瓶中加入30mL(26g)甲苯,按图所示装好药品和其他仪器;③向三颈烧瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);④控制温度约为50℃,反应大约10min,三颈烧瓶底有大量淡黄色油状液体出现;⑤分离出一硝基甲苯的总质量为27.20g。
请回答下列问题:
(1)使用仪器A前必须进行的操作是_______。
(2)该实验采用水浴加热,水浴加热的优点有:受热均匀、_______。
(3)配制混酸的方法是分别量取20mL浓硫酸和60mL浓硝酸,将浓_______倒入烧杯中,浓_______沿着烧杯内壁缓缓注入,并不断搅拌。
(4)控制温度约为50℃时,反应生成的产物一硝基甲苯是邻硝基甲苯和对硝基甲苯混合物,写出该反应生成对硝基甲苯的化学方程式_______。
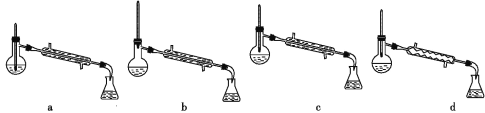
(5)分离反应后产物的方案如下:

①操作1的名称为_______。
②操作2中,下列仪器选择及安装正确的是_______(填字母)。
(6)该实验中一硝基甲苯的产率为_______(保留两位有效数字)。
【答案】检查是否漏液 准确控制温度(其他合理答案也可) 硝酸 硫酸 ![]() +HNO3
+HNO3![]()
![]() +H2O 分液 b 70%
+H2O 分液 b 70%
【解析】
(1)仪器A是分液漏斗,使用前验漏;
(2)水浴加热的优点是避免了直接加热造成的受热不均与温度的不可控性,许多反应需要严格的温度控制,就需要水浴加热;
(3)类似浓硫酸的稀释,浓硫酸、浓硝酸混合应把浓硫酸倒入浓硝酸中;
(4)苯和浓硝酸、浓硫酸的混合物发生取代反应生成对硝基甲苯和水;
(5)①有机混合物和无机混合物是互不相溶的液体;
②蒸馏操作需要测蒸气的温度;
(6)根据甲苯是质量计算一硝基甲苯的理论质量,产率=实际产量÷理论产量×100%;
(1)仪器A是分液漏斗,使用前检查是否漏液;
(2)该实验采用水浴加热,水浴加热的优点有:受热均匀、准确控制温度;
(3)浓硫酸密度大于浓硝酸,应将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌,防止将浓硝酸加到浓硫酸中可能发生的液体飞溅;
(4)甲苯和浓硝酸、浓硫酸的混合物发生取代反应生成对硝基甲苯和水,反应的化学方程式是![]() +HNO3
+HNO3![]()
![]() +H2O;
+H2O;
(5)①有机混合物和无机混合物是互不相溶的液体,所以用分液法分离有机混合物和无机混合物;
②蒸馏操作需要测蒸气的温度,所以温度计液泡应在蒸馏烧瓶支管口处,选b;
(6)根据方程式![]() +HNO3
+HNO3![]()
![]() +H2O,26g甲苯理论上生成一硝基甲苯的质量是
+H2O,26g甲苯理论上生成一硝基甲苯的质量是![]() ,产率=实际产量÷理论产量×100%=27.20g÷38.7g×100%=70%。
,产率=实际产量÷理论产量×100%=27.20g÷38.7g×100%=70%。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质。下列说法不正确的是( )
A.该反应是氧化还原反应
B.该反应的ΔH < 0
C.生成新物质的化学式为 Fe2S3
D.生成新物质的总能量低于反应物铁粉和硫粉的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因:______________;农业上用石膏降低其碱性的反应原理:__________。
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________(填“>”“<”或“=”)n。
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=__________。
(4)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1mol/L NH4Cl②0.1mol/L CH3COONH4 ③0.1mol/LNH4HSO4④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3H2O。
请根据要求填写下列空白:
(1)溶液①呈_____性(填“酸”、“碱”或“中”),其原因是________(用离子方程式表示)。
(2)比较②③溶液中,c(NH4+)的大小关系是②______③(填“>”“<”或“=”)。
(3)在溶液④中,_____ 离子的浓度为0.1mol/L;NH3H2O和_____离子的物质的量浓度之和为0.2mol/L。
(4)室温下,测得溶液②的pH=7,则CH3COO-的水解程度_____(填“>”“<”或“=”)NH4+-的水解程度。CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____c(NH4+)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)c(SO42﹣),所以在BaSO4溶液中有c(Ba2+)=c(SO42﹣)=![]()
③将0.1molL﹣1的NaHS和0.1molL﹣1Na2S溶液等体积混合,所得溶液中有c(S2﹣)+2c(OH﹣)=2c(H+)+c(HS﹣)+3c(H2S)
④在0.1mol/L氨水中滴加0.1mol/L盐酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10﹣a molL﹣1
A.①④B.②③C.③④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】
绿柱石被国际珠宝界公认为四大名贵宝石之一。主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿。试回答下列问题:
(1)基态Al原子中,电子填充的最高能级是_______,基态Cr原子的价电子排布式是_____。
(2)用“>”或“<”填空:
第一电离能 | 键能 | 沸点 | 离子半径 |
Be_____B | C—C_____Si—Si | H2S_____H2O | Al3+_____O2- |
(3)BeCl2分子的空间构型是______,它的二聚体Be2Cl4结构如右图所示,其中Be原子的杂化方式是_____。
![]()

(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式______。
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg·cm-3,则晶胞连长为___cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应(均未配平)中,氧化剂与还原剂物质的量的关系为1∶2的是
A.Cu+H2SO4![]() CuSO4+SO2↑+H2O
CuSO4+SO2↑+H2O
B.CH3COOH+Ca(ClO)2![]() HClO+Ca(CH3COO)2
HClO+Ca(CH3COO)2
C.I2+NaClO3![]() NaIO3+Cl2
NaIO3+Cl2
D.HCl+MnO2![]() MnCl2+Cl2↑+H2O
MnCl2+Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃组成的混合物共20g,混合气体的密度是相同状况下氢气密度的12.5倍,让混合气体通过装有溴水的试剂瓶时,试剂瓶的质量增加了16.8 g,组成该混合气体的可能是( )
A.甲烷和乙烯B.乙烷和丙烯C.乙烷和乙烯D.甲烷和丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强,食品添加亚硝酸钠必须严格控制用量。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
(1)测定溶液PH
用PH试纸分别测定0.1mol·L-1两种盐溶液的PH,测得NaNO2溶液呈碱性。NaNO2溶液呈碱性的原因是 ________________________(用离子方程式解释)。NaNO2溶液中c(HNO2)=_____________(用溶液中其它离子的浓度关系式表示)
(2)沉淀法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液。两只试管均产生白色沉淀。分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。
该温度下Ksp(AgNO2)=2×10-8(mol·L-1)2; Ksp(AgCl)=1.8×10-10(mol·L-1)2
则反应AgNO2(s) +Cl-(aq)![]() AgCl(s)+ NO2-(aq)的化学平衡常数K=__________
AgCl(s)+ NO2-(aq)的化学平衡常数K=__________
(3)氧化法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴酸性KMnO4溶液。使酸性KMnO4溶液褪色的是NaNO2溶液。该反应的离子方程式为____________。
㈡NaNO2性质探究
该兴趣小组同学用下图装置探究亚硝酸钠与硫酸反应及气体产物成分。
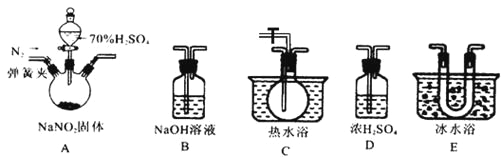
已知: 气体液化的温度:NO221℃ 、 NO –152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→______→ ______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①如何确认A中产生气体是否含有NO _________。(写出实验操作、现象和结论)
②装置E的作用是_______________________。
③若向D中通入过量O2,则装置B中发生反应的化学方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com