
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O,相对分子质量为990)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用制备聚氯乙烯的热稳定剂。以铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。
请回答下列问题:
(1)步骤①转化的目的是____________,滤液1中的溶质为Na2CO3和_________(填化学式);当沉淀转化达平衡时,滤液l中c(SO42-)与c(CO32-)的比值为___________;
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是___________________________(任写两条),其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为______________________________;
(3)滤液2中可循环利用的溶质为________________(填化学式);
(4)步骤⑥合成三盐的化学方程式为_______________________________________;
(5)简述步骤⑦洗涤沉淀的方法____________________________________________。
【答案】将PbSO4转化为PbCO3,提高铅的利用率 Na2SO4 1.25×105 适当升温(或适当增大硝酸浓度或减小程度颗粒直径等) 3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O HNO3 4PbSO4+6NaOH![]() 3PbO PbSO4H2O+3Na2SO4+2H2O 用玻璃棒引流,向过滤器中加蒸馏水直至浸没沉淀,待水自然流下后,重复2-3次。
3PbO PbSO4H2O+3Na2SO4+2H2O 用玻璃棒引流,向过滤器中加蒸馏水直至浸没沉淀,待水自然流下后,重复2-3次。
【解析】
以铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐,由流程可知,向铅泥中加Na2CO3溶液是将PbSO4转化成PbCO3,Na2CO3(aq)+PbSO4(s)=Na2SO4(aq)+PbCO3(s),所以滤液Ⅰ的溶质主要是Na2SO4和过量的Na2CO3,Pb、PbO和PbCO3在硝酸的作用下反应:3Pb+8HNO3=Pb(NO3)2+2NO↑+4H2O、PbCO3+2HNO3=Pb(NO3)2+CO2↑+H2O、PbO+2HNO3=Pb(NO3)2+2H2O,均转化成Pb(NO3)2,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,过滤的滤液为HNO3,可循环利用,向硫酸铅中加入氢氧化钠合成三盐和硫酸钠,发生4PbSO4+6NaOH![]() 3PbOPbSO4H2O+3Na2SO4+2H2O,滤液3主要是硫酸钠,洗涤沉淀干燥得到三盐,据此解答。
3PbOPbSO4H2O+3Na2SO4+2H2O,滤液3主要是硫酸钠,洗涤沉淀干燥得到三盐,据此解答。
(1)步骤①向铅泥中加Na2CO3溶液,由已知数据可知PbCO3的溶解度小于PbSO4的溶解度,Na2CO3(aq)+PbSO4(s)=Na2SO4(aq)+PbCO3,则可将PbSO4转化成PbCO3,所以滤液Ⅰ的溶质主要是Na2SO4和过量的Na2CO3,当沉淀转化达平衡时,滤液l中c(SO42-)与c(CO32-)的比值为![]() =1.2×105;
=1.2×105;
(2)酸溶时,为提高酸溶速率,可采取的措施是适当升温(或适当增大硝酸浓度或减小沉淀粒径等);铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O;
(3)Pb、PbO和PbCO3在硝酸的作用下转化成Pb(NO3)2,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,HNO3可循环利用;
(4)步骤⑥合成三盐的化学方程式为:4PbSO4+6NaOH![]() 3PbOPbSO4H2O+3Na2SO4+2H2O;
3PbOPbSO4H2O+3Na2SO4+2H2O;
(5)洗涤沉淀的方法为:用玻璃棒引流,向过滤器中加蒸馏水直至浸没沉淀,待水自然流下后,重复2-3次。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】【加试题】六氨氯化镁 (MgCl2·6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组在实验室以菱镁矿(主 要成分 MgCO3,含少量 FeCO3等杂质)为原料制备六氨氯化镁,实验流程图如下:
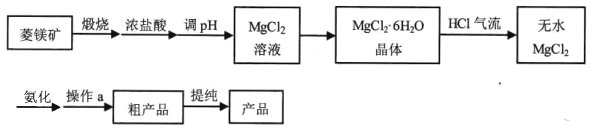
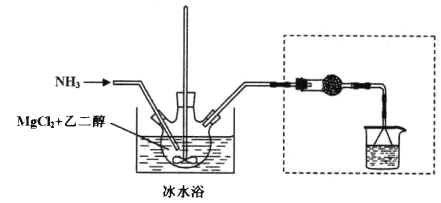
其中氨化过程装置示意图如下:
己知:(1)与Mg2+结合能力: H2O>NH3>HOCH2CH2OH>CH3OH
(2)相关物质的性质见下表:
物质名称 | 氨气的溶解性 | 氯化镁的溶解性 | 六氨氯化镁的溶解性 |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
请回答:
(1)调 pH适合的物质是________ (填化学式)。
(2)在空气中直接加热MgCl2·6H2O晶体得不到纯的无水MgCl2,原因是________(用化学方程式表示)。
(3)虚框内装置的作用: _______,操作a的名称是_________。
(4)提纯操作中,下列洗涤剂最合适的是_______。
A.冰浓氨水 B.乙二醇和水的混合液
C.氨气饱和的甲醇溶液 D.氨气饱和的乙二醇溶液
(5)制得产品后,该科研小组对产品的成分进行测定,其中氯离子含量检测方法如下:
a.称取1.420g样品,加足量硫酸溶解,配制成250mL溶液;
b.量取25.00mL待测液于锥形瓶中;
c.用0.2000mol/LAgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积;
d.重复b、c操作2~3次,平均消耗AgNO3标准溶液10.00mL。
① 配制样品溶液时加硫酸的原因___________。
② 该样品中氯离子百分含量为____________。
③ 将氯离子百分含量实验值与理论值 (36.04%)相比较,请分析造成此结果的可能原因有_________(己知滴定操作正确、硫酸根离子对检测无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。

下列说法正确的是
A. 卤素单质(X2)与水反应均可生成两种酸
B. 用电子式表示MgF2的形成过程为: ![]()
C. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
D. 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:MgI2(s)+Cl2(g)=MgCl2(s)+I2(g),ΔH=-277kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是
混合物 | 酸 | 盐 | 化合物 | |
A | CuSO4·5H2O | H2SO4 | NaCl | 盐酸 |
B | 碱石灰 | 醋酸 | 生石灰 | Na2O |
C | KNO3晶体 | NH4Cl | Cu2(OH)2CO3 | NaOH |
D | 澄清石灰水 | HNO3 | NaHSO4 | NaHCO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把少量废铁屑溶于过量稀硫酸中,过滤、除去杂质,在滤液中加入适量硝酸,再加入适量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红褐色的残渣。上述沉淀和残渣分别为( )
A.Fe(OH)3、Fe2O3B.Fe(OH)2、FeO
C.Fe(OH)2、Fe(OH)3;Fe3O4D.Fe2O3、Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂、反应条件和产物已略去):

已知:
Ⅰ. (R1,R2为烃基或氢)
(R1,R2为烃基或氢)
Ⅱ.![]() (R1,R2为烃基)
(R1,R2为烃基)
(1)B分子中所含官能团的名称为_______________,由F到G的反应类型为__________;
(2)乙炔和羧酸X发生加成反应生成E,E的核磁共振氢谱有三组峰,且峰面积比为3:2:1,E能发生水解反应,则E加聚后产物F的结构简式为__________________________;
(3)D和G反应生成光刻胶的化学方程式为_________________________;
(4)C的一种同分异构体满足下列条件:
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应
②苯环上的一氯取代产物只有两种。写出该同分异构体的结构简式:_________。
(5)根据已有知识并结合本题信息,写出以CH3CHO为原料制备CH3COCOCOOH的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) ______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中,有机化合物随处可见。请根据题意填空:
(1)炒菜时,加入酒和醋能使菜味香可口,原因是酒和醋反应生成了_______(填“酯”或“盐”);
(2)未成熟的苹果肉遇碘酒变_______(填“蓝”或“红”)色;
(3)聚乙烯制品用途很广。请完成由乙烯制取聚乙烯的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1mol X和2mol Y 加入2L的恒容密闭容器中发生反应:X(g)+2Y(g) ![]() 2 Z(g) △H=-akJ/mol,10min后测得Y的物质的量为1.4mol。下列说法不正确的是
2 Z(g) △H=-akJ/mol,10min后测得Y的物质的量为1.4mol。下列说法不正确的是
A.10min内Y的平均反应速率为0.03molL-1min-1
B.10min内容器中的气体密度逐渐减小
C.10min内反应放出的热量一定小于a kJ
D.升高容器温度,反应速率ν(正)、ν(逆)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述不正确的是

A. 化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因
B. 水分解生成氢气跟氧气的同时吸收能量
C. 1mol H2跟1/2mol O2反应生成1mol H2O释放能量一定为245kJ
D. 为开发氢能,可研究设法将太阳能聚焦,产生高温使水分解产生氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com