
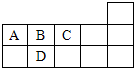
 右图是元素周期表的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
右图是元素周期表的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
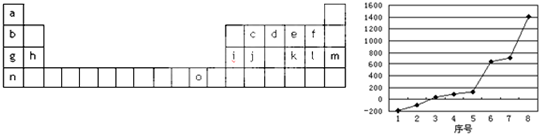
(13分)右图是元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。回答下列问题:
⑴请在右图中将过渡元素所在的位置“用斜线”画出。
⑵R的第一电离能 A的第一电离能(填大于、小于或等于);写出铷元素原子的外围电子排布式 ;
⑶R的氢化物在A的氢化物中溶解度极大,原因是 ;
A的氢化物比B的氢化物热稳定性强,原因是 。
⑷图中A、B两元素形成的离子中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是_________,依据是_______________________________。
⑸第三周期8种元素按单质熔点(℃)高低的顺序如右图,(已知序号“1”代表Ar),其中序号 “8”代表 (填元素符号);其中电负性最大的是 (填下图中的序号)。
⑹C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键的原因
_______________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2011-2012年四川省成都市六校协作体高二上学期期中考试化学试卷 题型:填空题
(13分)右图是元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。回答下列问题:
⑴请在右图中将过渡元素所在的位置“用斜线”画出。
⑵R的第一电离能 A的第一电离能(填大于、小于或等于);写出铷元素原子的外围电子排布式 ;
⑶R的氢化物在A的氢化物中溶解度极大,原因是 ;
A的氢化物比B的氢化物热稳定性强,原因是 。
⑷图中A、B两元素形成的离子 中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是_________,依据是_______________________________。
中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是_________,依据是_______________________________。
⑸第三周期8种元素按单质熔点(℃)高低的顺序如右图,(已知序号“1”代表Ar),其中序号 “8”代表 (填元素符号);其中电负性最大的是 (填下图中的序号)。
⑹C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键的原因
_______________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2014届浙江临海市高一下学期期中考试化学卷(解析版) 题型:选择题
元素周期表是学习化学的重要工具,右图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是

A.该元素的名称是钠 B.该元素的原子序数为11
C.该元素在地壳中的含量为22.99% D.该元素的元素符号为Na
查看答案和解析>>
科目:高中化学 来源:2011-2012年四川省成都市六校协作体高二上学期期中考试化学试卷 题型:填空题
(13分)右图是元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。回答下列问题:

⑴请在右图中将过渡元素所在的位置“用斜线”画出。
⑵R的第一电离能 A的第一电离能(填大于、小于或等于);写出铷元素原子的外围电子排布式 ;
⑶R的氢化物在A的氢化物中溶解度极大,原因是 ;
A的氢化物比B的氢化物热稳定性强,原因是 。
⑷图中A、B两元素形成的离子 中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是_________,依据是_______________________________。
中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是_________,依据是_______________________________。
⑸第三周期8种元素按单质熔点(℃)高低的顺序如右图,(已知序号“1”代表Ar),其中序号 “8”代表 (填元素符号);其中电负性最大的是 (填下图中的序号)。

⑹C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键的原因
_______________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com