
硫代硫酸钠(Na2S2O3)俗称保险粉,可用作定影剂,也可用于纸浆漂白、脱氯剂等。
Na2S2O3易溶于水,不溶于乙醇,常温下溶液中析出晶体通常为Na2S2O·5H2O。实验室制备保险粉的装置如下图所示。涉及的总化学方程式如下: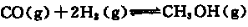
(1)检查虚线框内装置气密性的方法是? ????????????? 。
(2)反应前仪器a中加入的药品为???????? ,仪器c中加入的药品为 ?????????? 。
(3)仪器b的名称是?????????? 。
(4)在制备过程中,持续通人气体时,观察到B装置中先有大量浅黄色沉淀析出,反应一段时间,沉淀逐渐减少;待浅黄色沉淀消失时反应完成,停止加热。反应的离子方程式为??????? ???????????????? 。
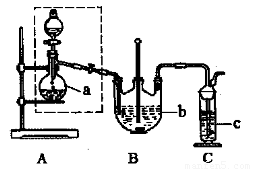
(5)反应完成后,为了从混合溶液中获取产品,操作如下:
操作②为????????????? 。
(6)为了测产品的纯度,称取8.000 g粗产品,配制成250 mL溶液,用移液管移取25.00 mL于锥形瓶中,再用0.05000 mol·L-l的碘标准溶液进行滴定(2S2O32-+I2=S4O62-+2I-),
平行3次实验,平均消耗碘标准溶液的体积为30.00mL。
①测得产品的纯度为????????? 。
②关于上述实验的有关操作,以下表述正确的是 ??????????? 。(填编号)
A.用碱式滴定管盛装碘标准溶液
B.用移液管移取25.00mL溶液于锥形瓶中,移液管的尖嘴和锥形瓶内壁要接触
C.如果滴定终点没有控制好,碘标准溶液滴加过量,则必须重新进行滴定
D.滴定过程中若剧烈摇动锥形瓶(溶液不外溅),则所测得的纯度将会偏高
(1)关闭蒸馏烧瓶右端活塞,往分液漏斗中加水,打开分液漏斗的活塞,水开始下滴,一段时间后,如果水不再下滴,表明气密性良好。反之则气密性不好。
(2)Na2SO3固体 NaOH溶液(或KMnO4溶液等)
(3)三颈烧瓶
(4)S2O32-+SO2+H2O=S↓+2HSO32-
(5)蒸发浓缩、冷却结晶
(6)①93.00% ②B
【解析】
试题分析:(1)检查虚线框内装置气密性的方法是关闭蒸馏烧瓶右端活塞,往分液漏斗中加水,打开分液漏斗的活塞,水开始下滴,一段时间后,如果水不再下滴,表明气密性良好。反之则气密性不好。(2)装置A是制取SO2的,反应前仪器a中加入的药品为Na2SO3固体,在分液漏斗内加入稀盐酸或稀硫酸。分数反应为:Na2SO3+H2SO4= Na2SO4+SO2↑+H2O;在装置B中加入Na2S。发生反应2Na2S+3SO2=2Na2SO3+3S ;Na2SO3+S=Na2S2O3。由于SO2或H2S都是大气污染物,所以未完全转化为Na2S2O3的SO2或H2S在装置C中被吸收。SO2或H2S都是酸性气体,同时也有还原性,所以仪器c中加入的药品为NaOH溶液(或KMnO4溶液等) 。(3)仪器b的名称是三颈烧瓶。(4)根据题意可得该反应的离子方程式为S2O32-+SO2+H2O=S↓+2HSO32-。(5)操作②从溶液中结晶析出晶体的操作是蒸发浓缩、冷却结晶。(6) ①由方程式2S2O32-+I2=S4O62-+2I-。可得n(Na2S2O3)=2n(I2)= 2×(0.05000 mol/L×0.03L)×(250 mL÷25.00 mL)=0.03mol.所以测得产品的纯度为(0.03mol×248g/mol)÷8.000g×100%=93.00%. ②A.碘单质有强的氧化性,容易腐蚀橡胶管,所以用酸式滴定管盛装碘标准溶液。错误。B.用移液管移取25.00mL溶液于锥形瓶中时,悬于移液管的尖嘴的液体是在量取体积范围内的,所以要和锥形瓶内壁要接触,使其滴入锥形瓶中。正确。C.测定样品的纯度就是以碘标准溶液为标准的,如果滴定终点没有控制好,碘标准溶液滴加过量,则可通过反滴加待测溶液。根据反应时二者的体积关系进行纯度的计算没有必须重新进行滴定。错误。D.滴定过程中若剧烈摇动锥形瓶,只要溶液不外溅,则二者就可以充分进行反应。所以对所测得的纯度无影响。错误。选项为B。
考点:考查装置气密性的检查、实验方案的设计、滴定法测定物质的纯度及实验误差分析的知识。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验方案 | 现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2014届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:实验题
硫代硫酸钠( Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氧剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。
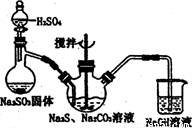
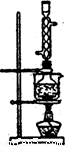
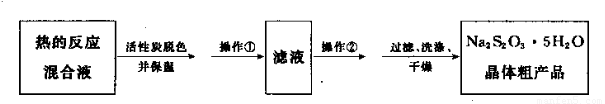
图l 图2
(1)用图l所示装置制取Na2S2O3,其中NaOH溶液的作用是: 。
如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有 (填化学式)杂质生成。
为测定所得保硷粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2 Na2S2O3+I2=2NaI+Na2S4O6。
(2)利用KIO3、KI和HCI可配制标准碘溶液。写出配制时所发生反应的离子方程式: 。
(3)准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加 作指示荆,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有 。
(4)若漓定时振荡不充分,刚看到溶液局部变色就停止漓定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果____(填“偏高”偏低”或“不变”)。
(5)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。
已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通人冷却水,水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下‘
④ ;
⑤ ;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com