
实验室需用90mL 2mol·L-碳酸钠溶液。
(1)配制该溶液时,根据你的实践经验,下列仪器不可能用到的是_____(填选项)。
A. 托盘天平 B. 烧杯 C. 胶头滴管 D. 100ml容量瓶 E. 90ml容量瓶 F.玻璃棒
(2)实验操作步骤有:A.称取碳酸钠晶体;B.用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶;C.将烧杯中的溶液转移到选定的容量瓶中;D.将碳酸钠晶体置于烧杯中用适量的水溶解,并用玻璃棒搅拌均匀;E.将配好的碳酸钠溶液装入试剂瓶待用并贴好标签;F.向容量瓶加水至刻度线1-2cm处改用胶头滴管滴加水至液面与刻度线相切;G.塞好瓶塞,反复上下颠倒摇匀。
①上述步骤的正确操作顺序是 B (填写字母)
②本实验称取的碳酸钠晶体的质量是 g
③若定容时仰视刻度线,则所配溶液浓度 (填“偏大”、“偏小”或“无影响”)
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理方法是 (填选项)。
A. 吸出多余液体,使凹液面与刻度线相切
B. 小心加热容量瓶溶液,经蒸发后,使凹液面与刻度线相切
C. 经准确计算加入一定量的浓硫酸
D. 重新配制碳酸钠溶液
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:填空题
近几年地球发生地震灾害较多,抢救地震后被困在废墟下的伤员,首要的措施是给伤员补充能量。下图是医院给伤员输液时用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列的内容后填写:
(1)葡萄糖的摩尔质量为________;
(2)该溶液中含水________g;
(3)该溶液的密度约为________g/mL;
(4)该溶液的物质的量浓度为________mol/L(精确到小数点后面两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________ mol·L-1。
(2)该同学取100 mL该“84消毒液”稀释后用于消毒,稀释后的溶液中
c(Na+)=________ mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)某实验需用480 mL含25%NaClO的消毒液。该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液。
①下列说法正确的是________。
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是________。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)下列物质中水溶液能导电但属于非电解质的有 (填序号)①乙醇 ②氨气 ③氯气 ④氯化钠 ⑤硫酸 ⑥干冰 ⑦BaSO4 ⑧醋酸 ⑨氢氧化钠 ⑩CaO
(2)某实验需要使用240ml 0.4mol/L CuSO4溶液,用胆矾配制该浓度溶液需要使用的仪器有托盘天平、烧杯、玻璃棒、 、 ;需要称量 克胆矾;若所称胆矾失去部分结晶水,则配制出的溶液浓度 。(填偏高、偏低或无影响)
(3)汉紫是中国古代兵马俑和古代壁画中的一种颜料,其化学式是BaCuSi2O6,请用氧化物的形式表示其组成: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32—、SO42—,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
(1)一定不存在的离子是________(填离子符号,下同)。
(2)由①可知存在离子为________,浓度________。由②可知存在离子为________,浓度________。
由③可知存在离子为________,浓度________。
(3)K+是否存在?________(填“是”或“否”),理由是___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨工业生产中所用的αFe催化剂的主要成分是FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为________。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为________(用小数表示,保留2位小数)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量碳粉,发生如下反应:2Fe2O3+C 4FeO+CO2↑。
4FeO+CO2↑。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是________(填序号);配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。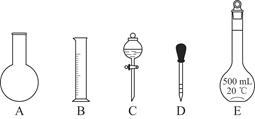
②下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为________g。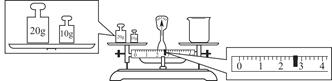
④根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某同学帮助水质检测站配制1000mL 1 mol·L-1NaOH溶液以备使用。
(1)该同学应选择___________mL的容量瓶。
(2)其操作步骤如下图所示,则如图操作应在下图中的 (填选项字母)之间。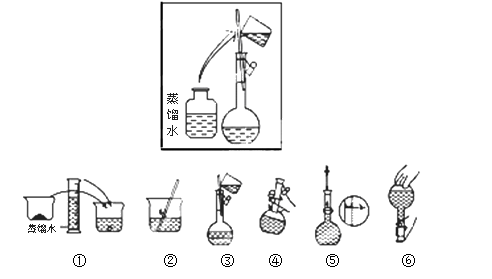
A.②与③ B.①与② C.④与⑤
(3)该同学应用托盘天平称取NaOH固体 g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项 (填选项字母)。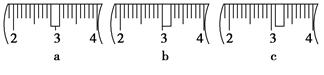
(4)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视读数,浓度会 ;
②转移溶液过程中,少量液体溅出来,浓度会 ;
③容量瓶未干燥,浓度会 ;
④定容摇匀后发现溶液凹面低于刻度线,浓度会 。
(5)配制溶液的实际操作过程中,动作要快,否则由于 ,会使配制的NaOH溶液的浓度比1 mol·L-1 (填“大”或“小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com