
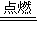 2SO2+2H2O,剩余气体可能为SO2或O2或二者都有;如氧气不足,发生2H2S+O2
2SO2+2H2O,剩余气体可能为SO2或O2或二者都有;如氧气不足,发生2H2S+O2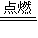 2S+2H2O,剩余气体H2S,以此解答该题.
2S+2H2O,剩余气体H2S,以此解答该题.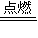 2SO2+2H2O,
2SO2+2H2O, =30mL>25mL,不符合;
=30mL>25mL,不符合;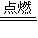 2S+2H2O,
2S+2H2O, +25mL=75mL,O2为100mL-75mL=25mL,
+25mL=75mL,O2为100mL-75mL=25mL,

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com