
 2SO2+2H2O,
2SO2+2H2O,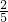 =30mL>25mL,不符合;
=30mL>25mL,不符合; 2S+2H2O,
2S+2H2O,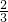 +25mL=75mL,O2为100mL-75mL=25mL,
+25mL=75mL,O2为100mL-75mL=25mL, 2SO2+2H2O,剩余气体可能为SO2或O2或二者都有;如氧气不足,发生2H2S+O2
2SO2+2H2O,剩余气体可能为SO2或O2或二者都有;如氧气不足,发生2H2S+O2 2S+2H2O,剩余气体H2S,以此解答该题.
2S+2H2O,剩余气体H2S,以此解答该题.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源:2011-2012学年上海市重点中学高一(下)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com