
【题目】在下图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)

请回答下列问题:
(1)A的化学式为_____。B的化学式为________。
(2)反应①的化学方程式为_________。
(3)反应②的离子方程式为_______。
【答案】NH3 O2 3NO2+H2O=2HNO3+NO 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【解析】
根据物质的性质及物质间的转化关系分析各物质的组成,书写相关反应方程式。
B是能使带火星的木条复燃的无色无味气体,则B是氧气。G是一种紫红色金属单质,则G是铜.A是常见气态氢化物,且能和氧气反应,所以根据图中的转化课判断,A可能是氨气,则C就是NO,F是水。NO和氧气反应生成NO2,NO2溶于水生成硝酸,则E是硝酸,硝酸和铜反应又生成NO;
(1)由以上分析可知A为氨气,B为氧气,故答案为: NH3;O2;
(2)反应①为二氧化氮与水生成硝酸的反应,方程式为:3NO2+H2O=2HNO3+NO;
(3)反应②为铜和稀硝酸的反应,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 需要加热才能发生的反应是吸热反应
B. 吸热反应一定需要加热才能发生
C. 所有的分解反应都是吸热反应
D. 需要持续加热才能发生的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。
(1)加入铝粉产生H2,说明铝具有__________(填“氧化性”或“还原性”)。
(2)该同学若H+大量存在,则NO3-就不能大量存在。设计实验证实如下:
装 置 | 现 象 |
| ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色 ⅲ. 试管变热,溶液沸腾 |
①盐酸溶解Al2O3薄膜的离子方程式是_______________________________。
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
实验 | 内容 | 现象 |
实验1 | 将湿润KI—淀粉试纸置于空气中 | 未变蓝 |
实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
a.浅棕色气体是____________。
b.实验1的目的是_______________________________。
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
______Al +______NO3-+_____ _ ==______Al 3++______NO+______ ,_______
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在。重新设计实验证实如下:
装 置 | 现 象 |
| ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,有刺激性气味 |
为确认“刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
①刺激性气味的气体是____________。
②产生该气体的离子方程式是____________________________________。
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是_________________________________。
(5)实验结果证实:NO3-在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物。试题中的无色溶液一定能大量存在的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质除杂和分离方法正确的是( )
被提纯物质 | 除杂试剂 | 分离方法 | |
A | 苯(苯甲酸) | 生石灰 | 蒸馏 |
B | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
C | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
D | 苯(苯酚) | 浓溴水 | 过滤 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. NA个氢氧化铁胶体粒子的质量为107g
B. 0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA
C. 100g质量分数为17%的H2O2水溶液中含O―O键数目为NA
D. 2.7g铝与足量的稀硫酸和氢氧化钠分别反应,得到氢气的体积在标况下均为3.36L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的电子排布式为______________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC3-的立体构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比________。
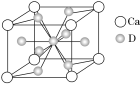
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H12O的某有机物与FeCl3溶液反应显色,又知其苯环上共有两个取代基,则该有机物的结构有( )
A.6种B.5种C.4种D.3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图均能表示甲烷的分子结构,按要求回答下列问题。
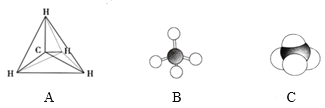
(1)甲烷的比例模型是______(填序号)。
(2)相对分子质量为100的烷烃的分子式是_____。
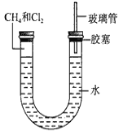
(3)甲烷与氯气的体积比为1:1,光照条件下在如图所示的装置中反应,则得到的产物为_____。
A.CH3Cl、HCl B.CCl4、HCl
C.CH3Cl、CH2Cl2 D.CH3Cl、CH2Cl2、CHCl3、CCl4、HCl
(4)甲烷最简单的同系物与氯气光照条件下反应,其生成物的化学式最多可能有_____种。
A.5 B.9 C.10 D.7
(5)经过几个小时的反应后,U形管右端的水柱变化是______。
A.升高 B.降低 C.不变 D.无法确定
(6)工业酒精含有甲醇,其结构简式为:CH3OH,可由甲烷经过一系列变化得到,写出甲醇与O2在铜作催化剂加热条件下的反应_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]()
D. NH4HSO4和NaOH混合呈中性C(Na+)>C(SO42—)>C(NH4+)>C(NH3·H2O)>C(H+)=C(OH—)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com