
【题目】一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。
(1)加入铝粉产生H2,说明铝具有__________(填“氧化性”或“还原性”)。
(2)该同学若H+大量存在,则NO3-就不能大量存在。设计实验证实如下:
装 置 | 现 象 |
| ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色 ⅲ. 试管变热,溶液沸腾 |
①盐酸溶解Al2O3薄膜的离子方程式是_______________________________。
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
实验 | 内容 | 现象 |
实验1 | 将湿润KI—淀粉试纸置于空气中 | 未变蓝 |
实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
a.浅棕色气体是____________。
b.实验1的目的是_______________________________。
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
______Al +______NO3-+_____ _ ==______Al 3++______NO+______ ,_______
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在。重新设计实验证实如下:
装 置 | 现 象 |
| ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,有刺激性气味 |
为确认“刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
①刺激性气味的气体是____________。
②产生该气体的离子方程式是____________________________________。
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是_________________________________。
(5)实验结果证实:NO3-在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物。试题中的无色溶液一定能大量存在的是_______________。
【答案】还原性6H++ Al2O3== 2Al3++ 3H2ONO2对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能1,1,4H+,1,1,2H2ONH38Al +3NO3-+ 5OH-+ 2H2O == 3NH3↑+ 8AlO2-2Al +2NaOH + 2H2O == 2NaAlO2+ 3H2↑Na+、OH-
【解析】
无色溶液中可能还有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生氢气,因为硝酸有氧化性,则无色溶液中应为氢氧化钠溶液。(1)加入铝粉产生氢气,铝失去电子,具有还原性。(2) ①氧化铝和盐酸反应生成氯化铝和水,离子方程式为:6H+ + Al2O3 == 2Al3+ + 3H2O ② 液面上显示浅棕色,一定不是氢气,为氮的氧化物,由将湿润的碘化钾淀粉试纸置于空气中未变蓝,说明碘化钾在空气中不能被氧化,而用湿润的碘化钾淀粉试纸检验浅棕色气体试纸变蓝,则碘化钾被氧化,即二氧化氮与水反应生成硝酸,再氧化碘离子生成碘单质。a.浅棕色的气体为NO2;b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能。C.铝和氢离子和硝酸根发生氧化还原反应生成硝酸铝和一氧化氮和水,离子方程式为Al +NO3- + 4H+==Al 3++NO +2H2O; (3) ①用湿润的碘化钾淀粉试纸检验,未变蓝,用湿润的红色石蕊试纸检验,试纸变蓝,则该气体为NH3;②由上述分析可知,碱性条件下铝和硝酸根离子发生氧化还原反应生成氨气,离子方程式为: 8Al +3NO3- + 5OH-+ 2H2O == 3NH3↑+ 8AlO2-; (4)氢氧化钠溶液中加入铝粉,结果只检验出氢气生成,即反应生成偏铝酸钠和氢气,反应的方程式为: 2Al +2NaOH + 2H2O == 2NaAlO2 + 3H2↑;(5)经过实验证实硝酸根在酸性或碱性条件下都可以氧化铝,生成氮的化合物,但是产物中没有氮的化合物,所以该无色溶液中含有的离子为Na+、OH- 。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】电动汽车以锂电池提供动力,锂电池技术已经成为汽车研究的前沿科技某锂电池的电池反应为:xLi+Li3-xNiCoMnO6![]() Li3NiCoMnO6,下列说法正确的是
Li3NiCoMnO6,下列说法正确的是![]()
A. 该电池的充、放电过程互为可逆反应
B. 放电时,电池的负极反应为Li-e-=Li+
C. 放电过程中,Li+向电池的负极移动
D. 该电池可以采用醋酸、乙醇等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示。下列结论不正确的是
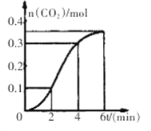
A.反应开始2分钟内平均反应速率最大
B.反应4分钟后平均反应速率最小
C.反应开始4分钟内温度对反应速率的影响比浓度大
D.反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇水蒸气重整制氢(SRM)是用于驱动电动汽车的质子交换膜燃料电池的理想氢源,当前研究主要集中在提高催化剂活性和降低尾气中CO含量,以免使燃料电池Pt电极中毒。重整过程发生的反应如下:
反应I CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ΔH1
CO2(g)+3H2(g) ΔH1
反应Ⅱ CH3OH(g)![]() CO(g)+2H2(g) ΔH2
CO(g)+2H2(g) ΔH2
反应Ⅲ CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,其中K2、K3随温度变化如下表所示:
125℃ | 225℃ | 325℃ | |
K2 | 05535 | 1858 | 9939.5 |
K3 | 1577 | 137.5 | 28.14 |
请回答:
(1)反应Ⅱ能够自发进行的条件_______(填“低温”、“高温”或“任何温度”),ΔH1____ΔH3(填“>”、“<”或“=”)。
(2)相同条件下,甲醇水蒸气重整制氢较甲醇直接分解制氢(反应Ⅱ)的先进之处在于___________________________________________________________________。
(3)在常压、Cat.1催化下,CH3OH和H2O混和气体(体积比1∶1.2,总物质的量2.2mol)进行反应,tl时刻测得CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。

注:曲线a表示CH3OH的转化率,曲线b表示CO的选择性,曲线c表示CO2的选择性
① 下列说法不正确的是__________。
A.反应适宜温度为300℃
B.工业生产通常在负压条件下进行甲醇水蒸气重整
C.己知Cat.2催化剂具有更高催化活性,可提高甲醇平衡转化率
D.添加CaO的复合催化剂可提高氢气产率
② 260℃时H2物质的量随时间的变化曲线如图所示。画出300℃时至t1时刻H2物质的量随时间的变化曲线。________________

(4)副产物CO2可以在酸性水溶液中电解生成甲酸,生成甲酸的电极反应式是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、Q、R的原子序数依次增大,其中X的单质是密度最小的气体,Z是同周期中原子半径最大的元素,Y与Q同主族,且Q的原子序数是Y的两倍。回答下列问题:
(1)Z的原子结构示意图为__________,R在元素周期表中的位置是______________。
(2)Z的最高价氧化物对应水化物所含化学键类型是_______________。Q、R的最高价氧化物对应的水化物酸性较强的是__________(填化学式)。
(3)由X和Y可以形成一种液态化合物T,T分子含18个电子,则其电子式为_______。将Q的低价氧化物通入T可以生成一种强酸,反应的化学方程式为___________________。
(4)氮元素的一种氢化物M,M分子含18个电子,用惰性电极,M、氧气和Z的最高价氧化物对应水化物的溶液设计一个燃料电池,则M发生的电极反应式为______________________。
(5)在2 L密闭容器中分别充入4 mol A气体和6 mol B气体,在一定条件下发生反应:4A(g)+5B(g)![]() 4C(g)+xD(g),5min后达到平衡状态,经测定B的转化率为75%,D的浓度为2.7 mol·L-1。则x=_______;A在平衡混合物中的体积分数为________;从反应开始至平衡时,以C的浓度变化表示该反应的平均速率v(C)=_____________。
4C(g)+xD(g),5min后达到平衡状态,经测定B的转化率为75%,D的浓度为2.7 mol·L-1。则x=_______;A在平衡混合物中的体积分数为________;从反应开始至平衡时,以C的浓度变化表示该反应的平均速率v(C)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类方法广泛适用于化学科学中,以下物质分类不正确的是
A.纯金属与合金均属于金属材料
B.纯碱和烧碱的水溶液均显示碱性,故均属于碱类
C.按分散质的粒子直径大小可将分散系分为溶液、浊液和胶体
D.溶于水后其水溶液能导电化合物不一定是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意完成下列问题:
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:_______________________________________。
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①则从反应开始到20min时,以NO表示的平均反应速率= ________,该温度下该反应的平衡常数K=____(保留两位小数)
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是_____(写一条即可)。
③下列描述中能说明上述反应已达平衡的是__________;
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为_______________
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。
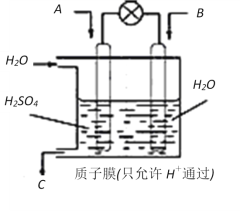
若A为SO2,B为O2,C为H2SO4,则负极反应式为_______________________________,电池总反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)

请回答下列问题:
(1)A的化学式为_____。B的化学式为________。
(2)反应①的化学方程式为_________。
(3)反应②的离子方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com