
(14分)食盐中含有一定量的镁、铁等物质,加碘盐中碘的损失主要由于杂质、水份、空气中的氧气以及光照,受热而引起的。
已知: 氧化性: IO3— >Fe3+ >I2 还原性:S2O32— > I—
反应式:3I2 + 6OH— == 5I— + IO3— + 3H2O KI + I2 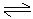 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+)。用适量蒸馏水溶解,并加稀硫酸酸化,将所得溶液分3份:第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入足量的KIO3固体后,滴加淀粉试剂,溶液不变色。
① 该红色物质是 (用化学式表示);CCl4中显示紫红色的物质是 (用电子式表示)。
② 第二份试液中加入足量KI固体后,反应的离子方程式为 ; 。
(2) KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式: 。
将I2溶于KI溶液,在低温条件下,可制得KI3?H2O。该物质作为食盐加碘剂是否合适?
(填“是”或“否”),并说明理由: 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是 。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+: 。
(14分)(1)①Fe(SCN)3,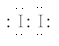 ②IO3-+5I-+6H+=3I2+3H2O或2Fe3++2 I-= I2+2Fe2+;
②IO3-+5I-+6H+=3I2+3H2O或2Fe3++2 I-= I2+2Fe2+;
(2)4KI+O2+2H2O=2I2+4KOH;否,KI3在受热或潮湿条件下产生I2和KI,KI易被氧化生成碘,碘易升华;
(3)AC
(4)取足量该碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如氯水、过氧化氢等),再滴加KSCN溶液,若溶液变血红色,则该加碘盐中存在Fe2+。
【解析】
试题分析:(1)①根据实验现象判断第一份溶液为红色,说明溶液中含有铁离子与KSCN反应生成Fe(SCN)3,所以红色物质是Fe(SCN)3, 第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色,说明紫色物质是碘单质,I2的电子式为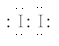 ;
;
②食盐中的碘酸根离子与碘离子在酸性条件下发生氧化还原反应生成单质碘,或者是铁离子与碘离子发生氧化还原反应生成了单质碘,离子方程式为IO3-+5I-+6H+=3I2+3H2O或2Fe3++2 I-= I2+2Fe2+;
(2)潮湿环境中KI与氧气发生氧化还原反应生成单质碘,碘易升华,引起碘的损失,反应的化学方程式为4KI+O2+2H2O=2I2+4KOH;用KI3?H2O作加碘试剂不合适,因为KI3?H2O是在低温下制取的,受热分解产生KI和碘单质,且KI易被氧化生成碘,碘易升华;
(3)提高加碘盐的稳定性主要是防止I-被氧化,所以应选择还原性的试剂。A中的S元素的化合价是+2价,先于I-被氧化,正确;B不能作还原剂,错误;C中的碳酸根离子与盐中的铁离子反应生成沉淀,防止铁离子氧化碘离子,正确;D、亚硝酸钠是有毒物质,错误,所以答案选AC。
(4)已经说明无铁离子,所以直接加入氧化性物质,再加入KSCN溶液若溶液变红则证明原物质中含有亚铁离子,具体操作如下:取足量该碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如氯水、过氧化氢等),再滴加KSCN溶液,若溶液变血红色,则该加碘盐中存在Fe2+。
考点:考查化学与社会生活的联系,电子式、化学方程式、离子方程式的书写,离子的检验,实验的设计


科目:高中化学 来源:2015届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
分子式为C10H20O2的有机物A,能在酸性条件下水解生成有机物C和D,且C在一定条件下可转化成D,则A的可能结构有( )
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2015届河南长葛第三实验高中高二下学期第一次考试化学试卷(解析版) 题型:选择题
写出下列反应的化学方程式,并注明反应类型。
(1)由乙烯制备聚乙烯 。
(2)由苯制环己烷 。
(3)用甲苯制TNT 。
(4)溴乙烷与NaOH的乙醇溶液共热 。
查看答案和解析>>
科目:高中化学 来源:2015届河南省高三上学期第一次测试化学试卷(解析版) 题型:填空题
(15分)已知几种离子的还原能力强弱顺序为I->Fe2+>Br-,现有200 mL混合溶液中含FeI2、FeBr2各0.10 mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其他反应)
(1)若氯水中有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是________,剩余Fe2+的物质的量为________。
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为________,若最终所得溶液为400 mL,其中主要阳离子及其物质的量浓度为________。
(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是________________________。
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸)。试写出此反应的离子方程式:_________________;上述所有反应共消耗Cl2________mol。
查看答案和解析>>
科目:高中化学 来源:2015届河南省高三上学期第一次测试化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是( )
A.FeO溶于足量稀HNO3:FeO+2H+ =Fe2++H2O
B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.向澄清石灰水中通入少量CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
D.将0.2mol/L的NH4Al(SO4)2溶液与0.4mol/L的Ba(OH)2溶液等体积混合: 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2015届河南省顶级名校高三入学定位考试化学试卷(解析版) 题型:选择题
下列判断正确的是
A.酸酐一定是氧化物 B.晶体中一定存在化学键
C.碱性氧化物一定是金属氧化物 D.正四面体分子中键角一定是109o28′
查看答案和解析>>
科目:高中化学 来源:2015届河南省顶级名校高三入学定位考试化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种易溶于水的物质,分别由 中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③向丙溶液中滴入
中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③向丙溶液中滴入 溶液有不溶于稀
溶液有不溶于稀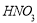 的白色沉淀生成,下列结论不正确的是
的白色沉淀生成,下列结论不正确的是
A.甲溶液含有 B.乙溶液含有
B.乙溶液含有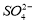 C.丙溶液含有
C.丙溶液含有 D.丁溶液含有
D.丁溶液含有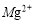
查看答案和解析>>
科目:高中化学 来源:2015届河南省偃师市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关金属的说法中,正确的是
①纯铁不容易生锈②钠着火用水扑灭
③铝在空气中耐腐蚀,所以铝是不活泼金属④缺钙会引起骨质疏松,缺铁会引起贫血
⑤青铜、不锈钢、硬铝都是合金⑥KSCN溶液可以检验Fe3+
A.①④⑤⑥ B.②③④⑤ C.①③④⑤D.①②⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高三第一次调研考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.酸、碱、盐都是电解质 B.电解质都是易溶于水的物质
C.氧化物都是电解质 D.氢化物都不是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com