
【题目】[化学与技术]水处理技术在生产、生活中应用广泛.
(1)含有较多离子的水称为硬水.硬水加热后产生碳酸盐沉淀的离子方程式为(写出一个即可)
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应首先使硬水通过(填“RH”或“ROH”)型离子交换树脂,原因是 .
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为 . 电渗析法净化水时,使离子通过半透膜的推动力是 .
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的 .
【答案】
(1)Ca2+、Mg2+;Ca2++2HCO3﹣ ![]() CaCO3↓+CO2↑+H2O或Mg2++2HCO3﹣
CaCO3↓+CO2↑+H2O或Mg2++2HCO3﹣ ![]() MgCO3↓+CO2↑+H2O
MgCO3↓+CO2↑+H2O
(2)RH;先通过阴离子交换树脂可能生成Mg(OH)2等沉淀而影响树脂交换效果
(3)反渗透法;电势差(或电场力)
(4)电导率(或电阻率)
【解析】解:(1)通常按水中Ca2+、Mg2+的多少,把天然水分为硬水和软水.含有较多Ca2+、Mg2+的水叫做硬水;如果水的硬度是由Ca(HCO3)2或Mg(HCO3)2所引起的,这种硬度叫做暂时硬度.具有暂时硬度的水可以用加热的方法进行软化,方程式为Ca2++2HCO3﹣ ![]() CaCO3↓+CO2↑+H2O或Mg2++2HCO3﹣
CaCO3↓+CO2↑+H2O或Mg2++2HCO3﹣ ![]() MgCO3↓+CO2↑+H2O,所以答案是:Ca2++2HCO3﹣
MgCO3↓+CO2↑+H2O,所以答案是:Ca2++2HCO3﹣ ![]() CaCO3↓+CO2↑+H2O或Mg2++2HCO3﹣
CaCO3↓+CO2↑+H2O或Mg2++2HCO3﹣ ![]() MgCO3↓+CO2↑+H2O;(2)如果水的硬度是由钙和镁的硫酸盐或氯化物等引起的,这种硬度叫做永久硬度.具有永久硬度的水可以采用离子交换法进行软化.离子交换剂中阳离子与水中的Ca2+、Mg2+发生离子交换作用,使水得到净化.如果硬水先通过ROH型阴离子交换树脂时可能产生Mg(OH)2等沉淀而影响交换效果,所以先通过RH型阳离子交换树脂.所以答案是:RH;先通过阴离子交换树脂可能生成Mg(OH)2等沉淀而影响树脂交换效果;(3)电渗析法是一种利用离子交换膜进行海水淡化的方法.在外加电场的作用下,水溶液中阴、阳离子会分别向两极移动,如果在中间加上一种交换膜,就可能达到分离浓缩的目的.所以电渗析法净化水时,使离子通过半透膜的推动力是电势差或电场力.所以答案是:反渗透法;电势差(或电场力);(4)因为水的电离程度极小,所以纯水是几乎不导电的,因此要检验蒸馏水的纯度时,最简单易行的方法是测定水的电导率或电阻率.所以答案是:电导率(或电阻率).
MgCO3↓+CO2↑+H2O;(2)如果水的硬度是由钙和镁的硫酸盐或氯化物等引起的,这种硬度叫做永久硬度.具有永久硬度的水可以采用离子交换法进行软化.离子交换剂中阳离子与水中的Ca2+、Mg2+发生离子交换作用,使水得到净化.如果硬水先通过ROH型阴离子交换树脂时可能产生Mg(OH)2等沉淀而影响交换效果,所以先通过RH型阳离子交换树脂.所以答案是:RH;先通过阴离子交换树脂可能生成Mg(OH)2等沉淀而影响树脂交换效果;(3)电渗析法是一种利用离子交换膜进行海水淡化的方法.在外加电场的作用下,水溶液中阴、阳离子会分别向两极移动,如果在中间加上一种交换膜,就可能达到分离浓缩的目的.所以电渗析法净化水时,使离子通过半透膜的推动力是电势差或电场力.所以答案是:反渗透法;电势差(或电场力);(4)因为水的电离程度极小,所以纯水是几乎不导电的,因此要检验蒸馏水的纯度时,最简单易行的方法是测定水的电导率或电阻率.所以答案是:电导率(或电阻率).
【考点精析】本题主要考查了离子交换的相关知识点,需要掌握对于某些无机类废液,可采用离子交换法处理,例如,含Pb2+的废液,使用强酸性阳离子交换树脂,几乎能把它们完全除去.若要处理铁的含氰配合物废液,也可采用离子交换法才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2 , 含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下: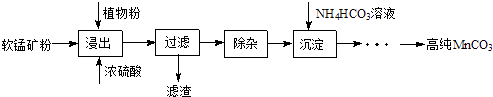
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是 , 植物粉的作用是 .
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+ , 而且能提高软锰矿的浸出率.写出双氧水提高软锰矿浸出率的离子方程式 .
(3)制备:在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀.温度控制35℃以下的原因是;该反应的化学方程式为;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 .
(4)计算:室温下,Ksp(MnCO3)=1.8×10﹣11 , Ksp(MgCO3)=2.6×10﹣5 , 已知离子浓度小于1.0×10﹣5molL﹣1时,表示该离子沉淀完全.若净化液中的c(Mg2+)=10﹣2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“”代表一种元素,其中P点代表氢元素。下列说法不正确的是( )
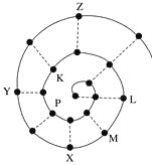
A. 图中虚线相连的元素位于同一族
B. P、K、L、M、X、Y、Z都是短周期元素
C. K元素位于常规周期表的第三周期第ⅥA族
D. M与Z 两种元素形成的化合物的化学式为MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为: Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4 (s)+2H2O (l)
2PbSO4 (s)+2H2O (l)
电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )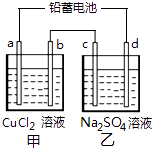
A.d极为阴极
B.若利用甲池精炼铜,b极应为粗铜
C.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42﹣(aq)+4e﹣=PbSO4(s)+2H2O(l)
D.若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 . CO等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为
利用反应6NO2+8NH3 ![]() 7N2+12H2O也可处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.
7N2+12H2O也可处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.
(2)已知:2SO2(g)+O2(g)![]()
![]() 2SO3(g)△H=﹣196.6kJmol﹣1
2SO3(g)△H=﹣196.6kJmol﹣1
2NO(g)+O2(g)═2NO2(g)△H=﹣113.0kJmol﹣1
则反应SO2(g)+NO2(g)=SO3(g)+NO(g)的△H=kJmol﹣1
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO2和NO的体积比保持不变 D.每消耗1molSO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图所示.该反应△H0(填“>”或“<”)实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 . 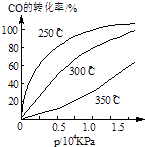
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现取m克铝镁合金与一定浓度的稀硝酸恰好完全反应(假定还原产物只有NO),向反
应后的混合溶液中滴加b mol/LNaOH溶液,当滴加到 V mL时,得到沉淀质量恰好为最
大值n克,则下列有关该实验的说法中不正确的是 ( )
A. 沉淀中氢氧根的质量为(n-m)g
B. 恰好溶解后溶液中的NO3-离子的物质的量为bV mol
C. 反应过程中转移电子的物质的量为![]() mol
mol
D. 参加反应硝酸的物质的量为(![]() )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
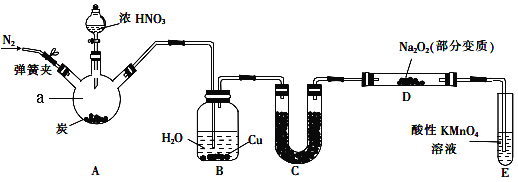
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂。某兴趣小组用如图所示装罝制备NaNO2并对其性质作如下探究(A中加热装罝已略去)。
查阅资料可知:
① 2NO+Na2O2![]() 2NaNO2;2NO2+Na2O2
2NaNO2;2NO2+Na2O2![]() 2NaNO3。
2NaNO3。
② NO能被酸性KMnO4氧化成NO3。
(1)装置中仪器a的名称为____________,A中反应的化学方程式是______________________。
(2)装置B中观察到的主要现象是____________________________________________________。
(3)装置C中盛放的试剂是__________________________。
(4)装置E的作用是_______________。
(5)A中滴入浓硝酸之前,应先通入N2一段时间,原因是__________________________________。
(6)写出NO被酸性KMnO4氧化的离子反应方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关醋酸溶液的叙述中不正确的是( )
A.pH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO﹣)
B.浓度为0.2 mol/L的CH3COOH溶液和浓度为0.1mol/L的NaOH溶液等体积混合后:c(CH3COO ﹣)﹣c(CH3COOH)=2[c(H+)﹣c(OH﹣)]
C.醋酸浓溶液加少量水稀释, ![]() 几乎不变
几乎不变
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4﹣)+c(C2O42﹣)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)。
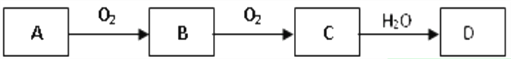
(1)若A是一种黄色单质固体,将B气体通入到酸性高锰酸钾溶液中能使其褪色,说明它具有______________性;
试写出D的浓溶液与碳反应的化学方程式为________________________________。
(2)若C是红棕色气体,则A的化学式为________或________;试写出D的稀溶液与铜反应的离子方程式_______________________________________;该反应中D的稀溶液表现出来的性质为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com