
����Ŀ���ߴ�̼�����ڵ��ӹ�ҵ������Ҫ��Ӧ�ã�ʪ���������̿���Ҫ�ɷ�ΪMnO2 �� ������Fe��Al��Mg������Ԫ�أ��Ʊ��ߴ�̼���̵�ʵ��������£�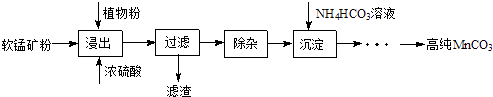
��1������������ʱ�¶ȿ�����90�桫95��֮�䣬����Ҫ��������3Сʱ��Ŀ���� �� ֲ��۵������� ��
��2�����ӣ��������Һ�м���һ������̼���̿��ڽ���Һ��pHΪ3.5��5.5�����ټ���һ���������̿��˫��ˮ�����ˣ�
�ۡ�
��������ʹ��̼���̵�pH�����������������м���˫��ˮ�����ܽ�Fe2+����ΪFe3+ �� ������������̿�Ľ����ʣ�д��˫��ˮ������̿�����ʵ����ӷ���ʽ ��
��3���Ʊ�����30�桫35���£���̼�������Һ�μӵ������̾���Һ�У����Ʒ�ӦҺ������pH��6.5��7.0���õ�MnCO3�������¶ȿ���35�����µ�ԭ�������÷�Ӧ�Ļ�ѧ����ʽΪ�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ����� ��
��4�����㣺�����£�Ksp��MnCO3��=1.8��10��11 �� Ksp��MgCO3��=2.6��10��5 �� ��֪����Ũ��С��1.0��10��5molL��1ʱ����ʾ�����ӳ�����ȫ��������Һ�е�c��Mg2+��=10��2mol/L���Լ���˵��Mg2+�Ĵ����Ƿ��Ӱ��MnCO3�Ĵ��ȣ�
���𰸡�
��1��������̿����̵Ľ����ʣ�����ԭ��
��2������MnCO3�IJ������������µ����ʵȣ���MnO2+H2O2+2H+=Mn2++2H2O+O2��
��3������̼����淋ķֽ⣬���ԭ�������ʣ�MnSO4+2NH4HCO3 ![]() MnCO3+��NH4��2SO4+CO2��+H2O��ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ�
MnCO3+��NH4��2SO4+CO2��+H2O��ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ�
��4���⣺Ksp��MnCO3��=c��Mn2+��c��CO ![]() ������Mn2+������ȫʱ��c��CO
������Mn2+������ȫʱ��c��CO ![]() ��=
��= ![]() ��10��5=1.8��10��6 molL��1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10��5/1.8��10��6=14.4 molL��1��Mg2+��Ũ��0.01mol/LԶС��14.4 molL��1��������Һ�е�c��Mg2+��=10��2mol/L��˵��Mg2+�Ĵ��ڲ���Ӱ��MnCO3�Ĵ��ȣ�
��10��5=1.8��10��6 molL��1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10��5/1.8��10��6=14.4 molL��1��Mg2+��Ũ��0.01mol/LԶС��14.4 molL��1��������Һ�е�c��Mg2+��=10��2mol/L��˵��Mg2+�Ĵ��ڲ���Ӱ��MnCO3�Ĵ��ȣ�
��Ksp ��MnCO3��=c��Mn2+��c��CO ![]() ������Mn2+������ȫʱ��c��CO
������Mn2+������ȫʱ��c��CO ![]() ��=
��= ![]() ��10��5=1.8��10��6 molL��1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10��5/1.8��10��6=14.4 molL��1��Mg2+��Ũ��0.01mol/LԶС��14.4 molL��1��������Һ�е�c��Mg2+��=10��2mol/L��˵��Mg2+�Ĵ��ڲ���Ӱ��MnCO3�Ĵ���
��10��5=1.8��10��6 molL��1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10��5/1.8��10��6=14.4 molL��1��Mg2+��Ũ��0.01mol/LԶС��14.4 molL��1��������Һ�е�c��Mg2+��=10��2mol/L��˵��Mg2+�Ĵ��ڲ���Ӱ��MnCO3�Ĵ���
���������⣺ʪ���������̿���Ҫ�ɷ�ΪMnO2 �� ������Fe��Al��Mg������Ԫ�أ��Ʊ��ߴ�̼���̣�����Ũ�����ֲ��۽������˵õ���Һ��ȥ���ʣ�����̼������γɳ���ͨ��һϵ�в����õ��ߴ�̼���̣���1�����¡����趼���Լӿ����ʵ��ܽⷴӦ���ʣ�����ʱ�¶ȿ�����90�桫95��֮�䣬����Ҫ��������3Сʱ��Ŀ����������̿����̵Ľ����ʣ�����ֲ�����һ�ֻ�ԭ�����ʴ�Ϊ��������̿����̵Ľ����ʣ�����ԭ������2��ʹ��̼���̵�pH�������Dz������µ����ʣ�������Һ�ж�������������������Ϊ��������������ԭΪ�����ӣ���Ӧ�����ӷ���ʽΪ��MnO2+H2O2+2H+=Mn2++2H2O+O2�����ʴ�Ϊ������MnCO3�IJ������������µ����ʵȣ��� MnO2+H2O2+2H+=Mn2++2H2O+O2������3������̼����������ֽ�������¶ȿ���35�����µ�ԭ���Ƿ�ֹ̼����立ֽ⣬��30�桫35���£���̼�������Һ�μӵ������̾���Һ�У����Ʒ�ӦҺ������pH��6.5��7.0���õ�MnCO3����������泥�������̼��ˮ����Ӧ�Ļ�ѧ����ʽΪ��MnSO4+2NH4HCO3 ![]() MnCO3+��NH4��2SO4+CO2��+H2O�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ��ϴ��Һ�����Ƿ��������������ƣ�ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ����ʴ�Ϊ������̼����淋ķֽ⣬���ԭ�������ʣ�MnSO4+2NH4HCO3
MnCO3+��NH4��2SO4+CO2��+H2O�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ��ϴ��Һ�����Ƿ��������������ƣ�ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ����ʴ�Ϊ������̼����淋ķֽ⣬���ԭ�������ʣ�MnSO4+2NH4HCO3 ![]() MnCO3+��NH4��2SO4+CO2��+H2O��ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ���
MnCO3+��NH4��2SO4+CO2��+H2O��ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ���
ʪ���������̿���Ҫ�ɷ�ΪMnO2 �� ������Fe��Al��Mg������Ԫ�أ��Ʊ��ߴ�̼���̣�����Ũ�����ֲ��۽������˵õ���Һ��ȥ���ʣ�����̼������γɳ���ͨ��һϵ�в����õ��ߴ�̼���̣���1�����½��趼���Լӿ����ʵ��ܽⷴӦ���ʣ�����ֲ�����һ�ֻ�ԭ������2��ʹ��̼���̵�pH�������Dz������µ����ʣ���������������������Ϊ��������������ԭΪ�����ӣ���3������̼����������ֽ��������30�桫35���£���̼�������Һ�μӵ������̾���Һ�У����Ʒ�ӦҺ������pH��6.5��7.0���õ�MnCO3����������泥�������̼��ˮ�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ��ϴ��Һ�����Ƿ��������������ƣ���4��Ksp ��MnCO3��=c��Mn2+��c��CO ![]() ������Mn2+������ȫʱ��c��CO
������Mn2+������ȫʱ��c��CO ![]() ��=1.8��10��11/1.0��10��5=1.8��10��6 molL��1 �� ��Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10��5/1.8��10
��=1.8��10��11/1.0��10��5=1.8��10��6 molL��1 �� ��Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10��5/1.8��10


 �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���1L0.1molL��1NH4Cl��Һ�У����ϼ������NaOH��NH4+��NH3H2O�ı仯������ͼ��ʾ������������仯�Ͱ��Ļӷ���������˵������ȷ���ǣ� �� 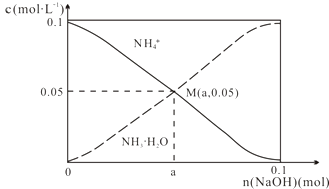
A.M����Һ��ˮ�ĵ���̶ȱ�ԭ��ҺС
B.��M��ʱ��n��OH������n��H+��=��a��0.05��mol
C.����NaOH�ļ��룬 ![]() ��������
��������
D.��n��NaOH��=0.1molʱ��c��OH������c��Cl������c��NH3?H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ�¶��£�0.01molL��1 NaOH��Һ��0.01molL��1��������ȣ�����˵����ȷ���ǣ� ��
A.��ˮ�������[H+]���
B.��ˮ�������[H+]����1.0��10��12 molL��1
C.��ˮ�������[OH��]����0.01 molL��1
D.���߶��ٽ���ˮ�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. 1 mol��Լ����6.02��1023����
B. 1 mol H2O�к��е���ԭ����Ϊ2NA
C. �Ƶ�Ħ�����������������ԭ������
D. 1 mol�������������98 g/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2020�������״�����У����ֺ�ҽ�þƾ��ڷ��߹���������Ҫ���ã�ҽ�ÿ����������IJ��Ƴɣ��IJ�����Ҫԭ���Ǿ۱�ϩ��֬������˵����ȷ���ǣ� ��
A.84����Һ��������������Ƭ��������������
B.�۱�ϩ��֬���ںϳ����߷��Ӳ���
C.ҽ�þƾ����Ҵ����������Ϊ 95%
D.������������ش�ŵ�Ŀ���DZ��⵰��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������м������ڴ������ͻ�(��ľ�ң��������´������ͻ���佡�������˵������ȷ���ǣ� ��
A.���������漰��ˮ�ⷴӦB.���ڴ������ͻ��������и�������
C.������������ҪΪNaOHD.�����������ɷֻ�����֬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���������ȷ����( )
A.2��3��5-��������
B.1��3-��������
C.2��3-����-2-�һ�����
D.2��3-����-4-�һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������غ��������Ļ����Һ����֪����Al3����Ũ��Ϊ0.4 mol/L�����������Ũ��Ϊ0.7 mol/L����K�������ʵ���Ũ��Ϊ
A. 0.1 mol/LB. 0.15 mol/LC. 0.3 mol/LD. 0.2 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ�뼼��]ˮ����������������������Ӧ�ù㷺��
��1�����н϶����ӵ�ˮ��ΪӲˮ��Ӳˮ���Ⱥ����̼���γ��������ӷ���ʽΪ��д��һ�����ɣ�
��2����RH�������ӽ�����֬��ROH�������ӽ�����֬������������ȻӲˮ��Ӧ����ʹӲˮͨ�����RH����ROH���������ӽ�����֬��ԭ���� ��
��3��ͨ��ʩ��һ��ѹ��ʹˮ����ͨ����Ĥ��������ӻ����ӽ������Ӷ���ô���ˮ�ķ�����Ϊ �� ������������ˮʱ��ʹ����ͨ����Ĥ���ƶ����� ��
��4����������ˮ�Ĵ���ʱ��������еķ����Dzⶨˮ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com