
【题目】下列说法正确的是( )
A. 1 mol氢约含有6.02×1023个微粒
B. 1 mol H2O中含有的氢原子数为2NA
C. 钠的摩尔质量等于它的相对原子质量
D. 1 mol硫酸的质量等于98 g/mol
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g),2min末反应达到平衡状态,生成0.8mol D,并测得C的浓度为0.4mol/L.由此推断:
(1)x值等于;
(2)A的转化率为;
(3)B的平衡浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有着广泛的应用. I.氧化铁是重要工业颜料,用废铁屑制备它的流程如图: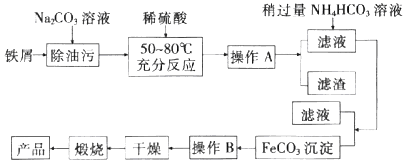
回答下列问题:
(1)操作A、B的名称分别是、;加入稍过量的NH4HCO3溶液的作用是 .
(2)写出在空气中充分加热煅烧FeCO3的化学方程式: .
(3)II.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质.某同学为测定产品中Fe2O3的含量,进行如下实验: a.称取样品8.00g,加入足量稀H2SO4溶解,并加水稀杯至100mL;
b.量取25.00mL待测溶液于锥形瓶中;
c.用酸化的0.01000molL﹣1KMnO4标准液滴定至终点;
d.重复操作b、c2~3次,得出消耗KMnO4溶液体积的平均值为20.00mL.
写出滴定过程中发生反应的离子方程式: .
(4)确定滴定达到终点的操作及现象为 .
(5)上述样品的质量分数为 .
(6)下列操作会导致样品中Fe2O3的质量分数的测定结果偏低的有 . a.未干澡锥形瓶 b.盛装标准液的滴定管没有用标准液润洗
c.滴定结束时仰视刻度线读数 d.量取待测液的滴定管没有润洗.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.试回答下列问题: 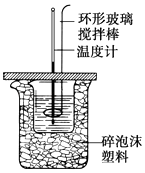
(1)大烧杯上如不盖硬纸板,求得的中和热数值将(填“偏大”、“偏小”或“无影响”).结合日常生活的实际该实验在中进行效果更好.
(2)实验中改用60m L 0.50molL﹣1盐酸与 50m L 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由 .
(3)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;用50m L 0.5molL﹣1 NaOH溶液进行上述实验,测得的中和热的数值会 . (均填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应aA(g)+bB(g)cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系: ![]() =K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关.现有反应:CO(g)+H2O (g)CO2(g)+H2(g)△H<0.在850℃时,K=1.
=K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关.现有反应:CO(g)+H2O (g)CO2(g)+H2(g)△H<0.在850℃时,K=1.
(1)若升高温度到950℃时,达到平衡时K1(填“大于”“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2 , 则:
①当x=5.0时,上述平衡向(填“正反应”或“逆反应”)方向移动.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29.
(1)F原子基态的外围核外电子排布式为 .
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是(用元素符号回答).
(3)元素B的简单气态氢化物的沸点(高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 .
(4)由A、B、C形成的离子CAB﹣与AC2互为等电子体,则CAB﹣的结构式为 .
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 .
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 . 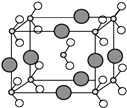
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2 , 含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下: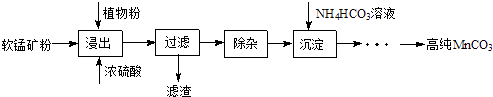
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是 , 植物粉的作用是 .
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+ , 而且能提高软锰矿的浸出率.写出双氧水提高软锰矿浸出率的离子方程式 .
(3)制备:在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀.温度控制35℃以下的原因是;该反应的化学方程式为;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 .
(4)计算:室温下,Ksp(MnCO3)=1.8×10﹣11 , Ksp(MgCO3)=2.6×10﹣5 , 已知离子浓度小于1.0×10﹣5molL﹣1时,表示该离子沉淀完全.若净化液中的c(Mg2+)=10﹣2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素aA、bB、cC、dD、eE的原子的结构示意图分别为
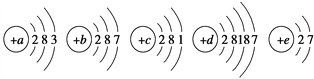
请回答下列问题:
(1)属于同周期的元素是__________(填元素符号,下同),属于同主族的元素__________。
(2)金属性最强的元素是__________,非金属性最强的元素是__________。
(3)上述元素中最高价氧化物对应的水化物碱性最强的是__________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为: Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4 (s)+2H2O (l)
2PbSO4 (s)+2H2O (l)
电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )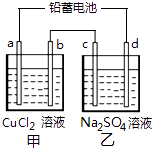
A.d极为阴极
B.若利用甲池精炼铜,b极应为粗铜
C.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42﹣(aq)+4e﹣=PbSO4(s)+2H2O(l)
D.若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com