
����Ŀ��ԭ���������������A��B��C��D��E��F����Ԫ�أ�����A�Ļ�̬ԭ����3����ͬ���ܼ������ܼ��еĵ�������ȣ�C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ��DΪ������������ԭ�Ӱ뾶��������Ԫ�أ�E��Cλ��ͬһ���壬F��ԭ������Ϊ29��
��1��Fԭ�ӻ�̬����Χ��������Ų�ʽΪ ��
��2����A��B��C����Ԫ���У���һ��������С�����˳��������Ԫ�ط��Żش𣩣�
��3��Ԫ��B�ļ���̬�⻯��ķе������ڣ����ڣ�Ԫ��A�ļ���̬�⻯��ķе㣬����Ҫԭ���� ��
��4����A��B��C�γɵ�����CAB����AC2��Ϊ�ȵ����壬��CAB���ĽṹʽΪ ��
��5����Ԫ��A��E���γɵij����������У�Aԭ�ӹ�����ӻ�����Ϊ ��
��6����B��C��D����Ԫ���γɵĻ����ᄃ��ľ�����ͼ��ʾ����û�����Ļ�ѧʽΪ �� 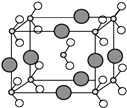
��7��FC�ڼ�������������ת��ΪF2C����ԭ�ӽṹ�ĽǶȽ���ԭ��
���𰸡�
��1��1s22s22p63s23p63d104s1��[Ar]3d104s1
��2��N��O��C
��3�����ڣ�B���⻯�����֮��������
��4��[N=C=O]��
��5��sp
��6��NaNO2
��7��Cu+��Χ����3d10���ȫ���ȶ���Cu2+��Χ����3d9������ӷ�ȫ���Ͱ���״̬���ȶ�
���������⣺ԭ���������������A��B��C��D��E��F����Ԫ�أ�A�Ļ�̬ԭ����3����ͬ���ܼ������ܼ��еĵ�������ȣ���A��CԪ�أ�C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ��Cԭ����������A����CΪOԪ�أ�Bԭ����������A��С��C����B��NԪ�أ�E��Cλ��ͬһ���壬��Eԭ������С��25����C��SԪ�أ�DΪ������������ԭ�Ӱ뾶��������Ԫ�أ�ԭ������С��S����D��NaԪ�أ�F��ԭ������Ϊ29��ΪCuԪ�أ���1��F��CuԪ�أ���ԭ�Ӻ�����29�����ӣ����ݹ���ԭ��֪CuԪ�ػ�̬ԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d104s1��[Ar]3d104s1 �� ���Դ��ǣ�1s22s22p63s23p63d104s1��[Ar]3d104s1����2��A��B��C�ֱ���C��N��OԪ�أ�ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ����Ե����ܴ�С����˳����N��O��C�����Դ��ǣ�N��O��C����3������������⻯���۵�ϸߣ����������к�������������в���������������۷е���ڼ��飬���Դ��ǣ����ڣ�B���⻯�����֮������������4���ȵ�����ԭ�Ӹ�����ȡ��۵�������ȣ���C��N��O�γɵ�����OCN����CO2��Ϊ�ȵ����壬���ݶ�����̼�ṹʽ֪OCN���Ľṹ��ʽΪ[N=C=O]�� �� ���Դ��ǣ�[N=C=O]������5����Ԫ��C��S���γɵij���������CS2�У�����̼����������ԭ�Ӽ۲���ӶԸ�����2�Ҳ����µ��Ӷԣ�����Cԭ�Ӳ���sp�ӻ������Դ��ǣ�sp����6����N��O��Na����Ԫ���γɵĻ����ᄃ��ľ�����ͼ��ʾ���þ�����Nԭ�Ӹ���=1+8�� ![]() =2��Oԭ�Ӹ���=2+16��
=2��Oԭ�Ӹ���=2+16�� ![]() =4��Naԭ�Ӹ���=8��
=4��Naԭ�Ӹ���=8�� ![]() =2�����Ըþ�����Na��N��Oԭ�Ӹ���֮��=2��2��4=1��1��2����ѧʽΪNaNO2 �� ���Դ��ǣ�NaNO2����7����ԭ���е��Ӳ�ȫ����������ȫ��Ϊ�ȶ�״̬��Cu+��Χ����3d10���ȫ���ȶ���Cu2+��Χ����3d9������ӷ�ȫ���Ͱ���״̬���ȶ������Դ��ǣ�Cu+��Χ����3d10���ȫ���ȶ���Cu2+��Χ����3d9������ӷ�ȫ���Ͱ���״̬���ȶ���
=2�����Ըþ�����Na��N��Oԭ�Ӹ���֮��=2��2��4=1��1��2����ѧʽΪNaNO2 �� ���Դ��ǣ�NaNO2����7����ԭ���е��Ӳ�ȫ����������ȫ��Ϊ�ȶ�״̬��Cu+��Χ����3d10���ȫ���ȶ���Cu2+��Χ����3d9������ӷ�ȫ���Ͱ���״̬���ȶ������Դ��ǣ�Cu+��Χ����3d10���ȫ���ȶ���Cu2+��Χ����3d9������ӷ�ȫ���Ͱ���״̬���ȶ���


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£��ܱ������ڷ������淴Ӧ3A+m Bn C�ﵽƽ�⣮
��1����A��C��Ϊ���壬BΪ���壬��ƽ�ⳣ������ʽΪK=��
��2����A��B��C��Ϊ���壬�ڼ�Сѹǿʱƽ�������ƶ�����3+mn�����������������=������
��3�����÷�Ӧ���κ��¶��¶����Է����У����H��0����S0�����������������=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ���ǣ� ��
A. 36.5g HCl�����ķ�����ΪNAB. 22.4L H2O�����ķ�����ΪNA
C. NA����ԭ�ӵ�����Ϊ2gD. 1 mol NaCl�к�0.5NA��Na+��0.5NA��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��һ����Ũ���ᷴӦ���õ�����ͭ��Һ��NO2��NO�Ļ�����壬��Щ������1.68 L O2(��״��)��Ϻ�ͨ��ˮ�У�����������ȫ��ˮ�����������ᡣ������������ͭ��Һ����μ���60 mL NaOH��Һ��Cu2��ǡ����ȫ��������NaOH��Һ��Ũ����
A. 3 mol��L��1 B. 4 mol��L��1
C. 5 mol��L��1 D. 6 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. 1 mol��Լ����6.02��1023����
B. 1 mol H2O�к��е���ԭ����Ϊ2NA
C. �Ƶ�Ħ�����������������ԭ������
D. 1 mol�������������98 g/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ�е�Ԫ�ؼ��仯�����ת����ϵ���ش�������
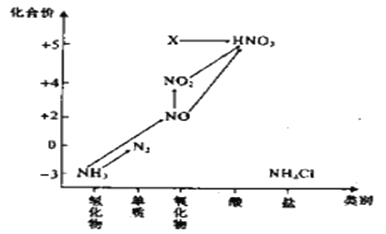
��1��ʵ���ҳ���NH4Cl��Ca(OH)2��ȡ�������÷�Ӧ�Ļ�ѧ����ʽΪ________________________________________________________________��
��2����������Դ�����Ⱦ��Ҫ��Σ����____________________������һ�㼴�ɣ�
��3����Ҫ��NH3��N2����ԭ���Ͽ��������Լ����е���_______________��
A.O2 B.Na
C.NH4Cl D.NO2
��4��ͼ��Xת��ΪHNO3�Ļ�ѧ����ʽΪ��____________________________________��
��5��ͼ���ڱ�״���½�NO2��NO��O2��ϲ�������������������������ˮ�У�������ȫ�ܽ⣬������ʣ�࣬������Ҳ����ɢ����������Һ�����ʵ���Ũ��M������ֵ��С��ΧΪ___________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������м������ڴ������ͻ�(��ľ�ң��������´������ͻ���佡�������˵������ȷ���ǣ� ��
A.���������漰��ˮ�ⷴӦB.���ڴ������ͻ��������и�������
C.������������ҪΪNaOHD.�����������ɷֻ�����֬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ؿ�������������������ѧ��ѧ����������������ҵ�ϣ������̿��Ƹ�����ص��������£�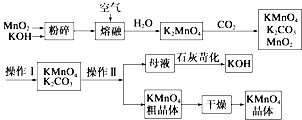
��ش��������⣺
��1������������Ҫ������CO2���壮д��ʵ������ȡCO2�Ļ�ѧ����ʽ ��
��2��KMnO4ϡ��Һ��һ�ֳ��õ���������������ԭ��������������ͬ����������ĸ����a��75%�ƾ� b��˫��ˮ c������ d�� 84����Һ��NaClO��Һ��
��3��д���������̺�����������������ͨ�����ʱ��������Ҫ��ѧ��Ӧ�ķ���ʽ�� ��
��4�����������п���ѭ��ʹ�õ�����������д��ѧʽ����
��5���ⶨ���������Ʒ���Ȳ��������̵ζ�������������Һ�еμ���������Һ��������ɫ����������Һ���Ϻ�ɫ�պ���ɫ�Ұ���Ӳ��ָ��������ﵽ�ζ��յ㣮д���÷�Ӧ�����ӷ���ʽ�� ��
��6����֪�������£�Ksp[Mn��OH��2]=2.4��10��13 �� ��ҵ�ϣ�����pH���Գ�����ˮ��Mn2+ �� ��pH=10ʱ����Һ��c��Mn2+��= ��
��7��������������������������KMnO4��K2CO3���������ܽ����ϵIJ��죬��������������裩�����ȹ��˵õ�KMnO4�־��壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ھ��������˵����ȷ���ǣ� ��
A.ֻҪ���н��������ӵľ����һ�������Ӿ���
B.���Ӿ�����һ��������������
C.�ڹ��ۻ���������и�ԭ�Ӷ��γ�8���ӽṹ
D.���Ӿ�����۵㲻һ���Ƚ��������۵��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com