
【题目】常温下,向1L0.1molL﹣1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( ) 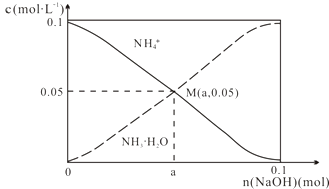
A.M点溶液中水的电离程度比原溶液小
B.在M点时,n(OH﹣)﹣n(H+)=(a﹣0.05)mol
C.随着NaOH的加入, ![]() 不断增大
不断增大
D.当n(NaOH)=0.1mol时,c(OH﹣)>c(Cl﹣)﹣c(NH3?H2O)
【答案】C
【解析】解:A.M点是向1L 0.1molL﹣1NH4Cl溶液中,不断加入NaOH固体后反应得到氯化铵和一水合氨溶液,铵根离子浓度和一水合氨浓度相同,一水合氨是一元弱碱抑制水电离,此时水的电离程度小于原氯化铵溶液中水的电离程度,故A正确; B.在M点时溶液中存在电荷守恒,n(0H﹣)+n(Cl﹣)=n(H+)+n(Na+)+n(NH4+),n(0H﹣)﹣n(H+)=0.05+n(Na+)﹣n(Cl﹣)=(a﹣0.05)mol,故B正确;
C.铵根离子水解显酸性,结合水解平衡常数分析, ![]() ×
× ![]() =
= ![]() ,随氢氧化钠固体加入,反应生成一水合氨浓度增大,平衡常数不变,则
,随氢氧化钠固体加入,反应生成一水合氨浓度增大,平衡常数不变,则 ![]() 减小,故C错误;
减小,故C错误;
D.向1L 0.1molL﹣1NH4Cl溶液中,不断加入NaOH固体后,当n(NaOH)=0.1mol时,恰好反应生成氯化钠和一水合氨,c(Na+)=c(Cl﹣)>c(OH﹣),溶液中存在水的电离则溶液中,c(OH﹣)>c(Cl﹣)﹣c(NH3H2O),故D正确;
故选C.
A.M点是向1L 0.1molL﹣1NH4Cl溶液中,不断加入NaOH固体后反应得到氯化铵和一水合氨溶液,铵根离子浓度和一水合氨浓度相同,一水合氨是一元弱碱抑制水电离;
B.依据溶液中电荷守恒分析判断,n(Na+)=amol,n(Cl﹣)=1mol;
C.铵根离子水解显酸性,结合水解平衡常数分析, ![]() ×
× ![]() =
= ![]() ;
;
D.向1L 0.1molL﹣1NH4Cl溶液中,不断加入NaOH固体后,当n(NaOH)=0.1mol时,恰好反应生成氯化钠和一水合氨,c(Na+)=c(Cl﹣)>c(OH﹣).


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 漂白粉溶液中通入过量的CO2: Ca2++2ClO-+ CO2+ H2O = CaCO3↓+2HClO
B. 氯气与水的反应: Cl2+H2O![]() 2H++Cl-+ClO—
2H++Cl-+ClO—
C. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3—+Ba2++OH-=BaCO3↓+H2O
D. 钠和冷水反应 : Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g),2min末反应达到平衡状态,生成0.8mol D,并测得C的浓度为0.4mol/L.由此推断:
(1)x值等于;
(2)A的转化率为;
(3)B的平衡浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L-1和0.4 mol·L-1。向该混合溶液中加入1.92 g铜粉,加热,待充分反应后(假设反应前 后溶液体积不变),所得溶液中Cu2+的物质的量浓度是( )
A. 0.15 mol·L-1 B. 0.225 mol·L-1
C. 0.30 mol·L-1 D. 0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】amolFeS与bmolFeO投入VLcmol/L的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3﹣的量为( )
A.62(a+b)g
B.186(a+b)g
C.(cV﹣ ![]() )mol
)mol
D.(cV﹣ ![]() )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验操作的说法中正确的是
A. 分液时,下层液体从下口放出,上层液体从上口倒出
B. 蒸发时,应使混合物中的水分完全蒸干后,再停止加热
C. 蒸馏时,温度计的水银球插入液面以下
D. 用100mL量简量取8.5mL浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有着广泛的应用. I.氧化铁是重要工业颜料,用废铁屑制备它的流程如图: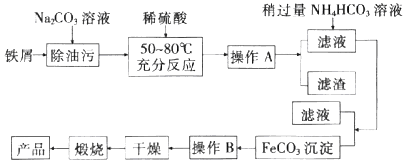
回答下列问题:
(1)操作A、B的名称分别是、;加入稍过量的NH4HCO3溶液的作用是 .
(2)写出在空气中充分加热煅烧FeCO3的化学方程式: .
(3)II.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质.某同学为测定产品中Fe2O3的含量,进行如下实验: a.称取样品8.00g,加入足量稀H2SO4溶解,并加水稀杯至100mL;
b.量取25.00mL待测溶液于锥形瓶中;
c.用酸化的0.01000molL﹣1KMnO4标准液滴定至终点;
d.重复操作b、c2~3次,得出消耗KMnO4溶液体积的平均值为20.00mL.
写出滴定过程中发生反应的离子方程式: .
(4)确定滴定达到终点的操作及现象为 .
(5)上述样品的质量分数为 .
(6)下列操作会导致样品中Fe2O3的质量分数的测定结果偏低的有 . a.未干澡锥形瓶 b.盛装标准液的滴定管没有用标准液润洗
c.滴定结束时仰视刻度线读数 d.量取待测液的滴定管没有润洗.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2 , 含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下: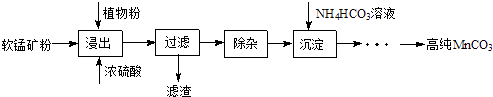
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是 , 植物粉的作用是 .
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+ , 而且能提高软锰矿的浸出率.写出双氧水提高软锰矿浸出率的离子方程式 .
(3)制备:在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀.温度控制35℃以下的原因是;该反应的化学方程式为;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 .
(4)计算:室温下,Ksp(MnCO3)=1.8×10﹣11 , Ksp(MgCO3)=2.6×10﹣5 , 已知离子浓度小于1.0×10﹣5molL﹣1时,表示该离子沉淀完全.若净化液中的c(Mg2+)=10﹣2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com