
(1)将复杂硅酸盐改写成氧化物形式:KAlSi3O8:________________。
(2)有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①将白色粉末加水溶解,得无色溶液。
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B。
根据上述现象判断:
①A的化学式是 B的化学式是 。
②原白色粉末中一定含有 ,可能含有 ,对可能含有的物质,可通过 (填实验名称)进一步检验。检验操作步骤有:①蘸取待测液②置于酒精灯火焰上灼烧 ③透过蓝色钴玻璃观察 ④用稀盐酸洗净铂丝。其中正确的操作顺序为 。
A.①②③④ B.④①②③ C.④②①②③④ D.①③②④
(8分,每一问2分,其余每空1分)(1)K2O·Al2O3·6SiO2
(2)①BaCO3 AgCl ②NaHCO3、BaCl2 KCl 焰色 C
解析试题分析:(1)硅酸盐改写成氧化物形式的顺序是活泼金属氧化物→较活泼金属氧化物→二氧化硅→水,所以将KAlSi3O8改写的结果是K2O·Al2O3·6SiO2。
(2)将白色粉末加水溶解,得无色溶液,说明不存在氯化铁,乙烷铁离子在溶液中显棕黄色;向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,该沉淀只能是碳酸钡,所以一定含有碳酸氢钠与氯化钡。由于氯化钡与硫酸不能大量共存,所以一定没有硫酸;过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B,则B应该是氯化银。由于氯化钡中也含有氯离子,所以不能确定是否含有氯化钾。
①A的化学式是BaCO3,B的化学式是AgCl。
②原白色粉末中一定含有NaHCO3、BaCl2,可能含有KCl;由于不同的金属表现出焰色反应不同,因此要进一步检验是否含有氯化钾,可以通过焰色反应鉴别;做焰色反应时首先用稀盐酸洗涤铂丝,然后灼烧,在蘸取灼烧,其中观察钾的焰色反应还需要透过蓝色的钴玻璃观察,实验结束后还需要再一次洗涤铂丝,即正确的顺序是④②①②③④,答案选C。
考点:考查硅酸盐氧化物表示、物质的检验与判断、焰色反应


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。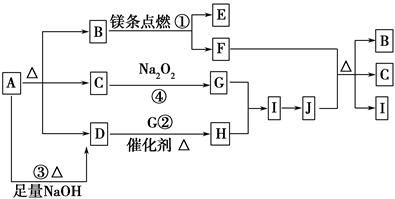
已知:2Mg+CO2 2MgO+C,请填写以下空白:
2MgO+C,请填写以下空白:
(1)A的化学式________。
(2)写出反应②的化学方程式:________________________________________。
(3)写出反应③的离子方程式:________________________________________。
(4)J与F反应的化学方程式:_________________________________________。
(5)在反应④中,当生成标准状况下2.24 L G时,转移电子数为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。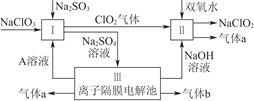
(1)双氧水的结构式为____________;Ⅰ中发生反应的还原剂是__________(填化学式)。
(2)Ⅱ中反应的离子方程式是_____________________________________________________________________________________________________________________________________。
(3)A的化学式是________,装置Ⅲ中A在________极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式:________________________________________________________________________________________________________________________________________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2。用离子方程式解释产生Cl2的原因:________________________________________________________________________
________________________________________________________________________。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量NaClO2,其中一份给以适当条件使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量________(填“相同”“不相同”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
近年,为提高能利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 .用这种方法处理SO2废气的优点是 .
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下: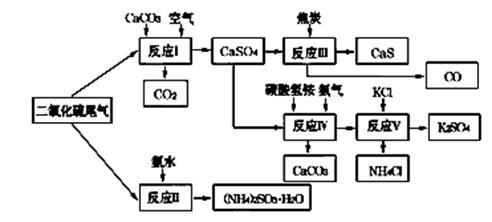
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 .
②下列有关说法正确的是 (填序号)。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C  CaS+4CO↑ CaS+4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在半导体工业中有这样一句话:“从沙滩到用户”,其中由粗硅制纯硅的常用方法为:Si(粗)+2Cl2=SiCl4 SiCl4+2H2=Si(纯)+4HCl。若在25℃101KPa条件下反应生成HCl气体49L(注:25℃101KPa条件下气体摩尔体积为24.5L/mol)则:
(1)反应生成HCl气体的质量为__________,转移电子的个数为_____________。
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20g/mL的盐酸,此盐酸的物质的量浓度为 。
(3)“从沙滩到用户”涉及到多个反应,其中制取粗硅的反应方程式为 ,纯净的石英砂与烧碱反应可以制得水玻璃,反应的离子方程式为 。
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O 13%,CaO 11.7%,SiO2 75.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需要上述原料的质量是 t(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碳族元素是形成化合物种类最多的元素。
(1)碳原子2个2p电子的运动状态不相同的方面是_______;C5HxN分子中C、N原于最外层都达到8电子稳定结构,则x的值可能为_______ (选填序号)。
a.10 b.11 c.13 d.15
(2)如图是金刚石晶体的结构示意图。则关于金刚石的描述正确的是 (选填序号)。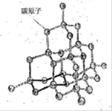
a.C-C键键角都为109°28’ b.最小的环由6个C原子构成
c.可溶于非极性溶剂 d.l mol金刚石含有4 mol C-C键
(3)以下比较错误的是________(选填序号)。
a.稳定性SiH4>CH4 b.沸点SiH4>CH4
c.熔点SiC>Si d.键能C=C>C-C
(4)NaBH4是广泛使用的有机反应还原剂,其中H为-1价,SiO2为其制备原料之一。
①配平以下制备NaBH4的化学方程式:□Na2B4O7+□Na+□SiO2+□H2→□NaBH4+□Na2SiO3
②反应中被还原的元素为________。
(5)碳酸钙是石灰石、方解石等的主要成分,可以形成“喀斯特”地貌、钟乳和石笋,有关反应的化学方程式为_________________________________________。
(6)若物质组成相似,可相互推算组成元素的相对原子质量。某学习小组模拟求算锗的相对原子质量,测得了锗酸钠中Na和Ge的质量分数、硅酸钠中Na和Si的质量分数,他们还需查阅的数据是______(选填序号)。
a.氧元素的相对原子质量
b.硅元素的相对原子质量
c.钠元素的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或受热。实验室以电解法制备ClO2的流程如下: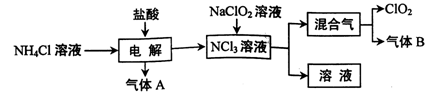
(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示方法制得的混合气中杂质气体B能使石蕊试液显蓝色,除去该杂质气体可选用 __;
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品。下列说法正确的是 ;
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,但该方法缺点是产率低、产品难以分离,还可能污染环境。写出该方法发生的化学方程式 ;
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是
,此法相比欧洲方法的优点是
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Na2SO3是常用的抗氧剂。
(1)实验室通常用浓硫酸(1:1)和Na2SO3微热制备SO2气体,
反应方程式为: ,制备的SO2气体中通常含有水蒸气,下列干燥剂能干燥SO2气体的是: ;
A.浓硫酸 B.碱石灰 C.无水CaCl2
(2) 少量SO2气体通入NaOH溶液中可得NaOH和Na2SO3的混合溶液,向该混合溶液中加入少许溴水,振荡后溶液变为无色。碱性溶液中Br2与Na2SO3发生氧化还原反应,反应的离子方程式为______________;
(3)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告;
限选试剂:2 mol·L-1HCl;1 mol·L-1H2SO4;1mol·L-1HNO3;1 mol·L-1BaCl2;
1 mol·L-1Ba(NO3)2;0.1 mol·L-1AgNO3;CCl4;苯;新制饱和溴水;新制饱和氯水。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液于试管A中,滴加2 mol·L-1HCl至溶液呈酸性,加入几滴________(填试剂),振荡 | ________,证明待测液中含SO32- |
| 步骤② | 另取少量待测液于试管B中,加入 ,再滴加适量 1 mol·L-1 BaCl2溶液 | |
| 步骤③ | 另取少量待测液于试管C中, ,振荡,静置后观察颜色 | 溶液分层,上层液体呈橙红色,证明待测液中很Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A经如右图所示的过程转化为D, 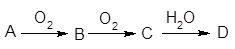
请回答下列问题:
(1)若A为非金属单质,且常温下为淡黄色固体,B为刺激性气味的无色气体,能使品红溶液褪色,D为强酸。
①D的化学式是 。
②在工业生产中B气体的大量排放被雨水吸收后形成了 而污染了环境。某工厂净化残余的B气体装置如图,则除去B气体的总反应方程式是 。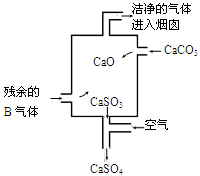
(2)若A是能使酚酞试液变红的气体。D是一种强酸。写出A→B的化学方程式 ;工业生产上,以34吨A为原料,最多可以生产63%的D酸 吨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com