
在半导体工业中有这样一句话:“从沙滩到用户”,其中由粗硅制纯硅的常用方法为:Si(粗)+2Cl2=SiCl4 SiCl4+2H2=Si(纯)+4HCl。若在25℃101KPa条件下反应生成HCl气体49L(注:25℃101KPa条件下气体摩尔体积为24.5L/mol)则:
(1)反应生成HCl气体的质量为__________,转移电子的个数为_____________。
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20g/mL的盐酸,此盐酸的物质的量浓度为 。
(3)“从沙滩到用户”涉及到多个反应,其中制取粗硅的反应方程式为 ,纯净的石英砂与烧碱反应可以制得水玻璃,反应的离子方程式为 。
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O 13%,CaO 11.7%,SiO2 75.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需要上述原料的质量是 t(保留两位小数)。
(1)73g 4NA
(2)12mol/L
(3)SiO2+2C Si(粗)+2CO↑ SiO2+2OH-=SiO32-+H2O
Si(粗)+2CO↑ SiO2+2OH-=SiO32-+H2O
(4)12.65
解析试题分析:(1)25℃101KPa条件下气体摩尔体积为24.5L/mol,49L HCl气体的物质的量为2mol,其质量为2mol×36.5g/mol=73g,两个反应共转移电子个数为4NA。
(2)溶质质量为73g,水的质量为127g,所以溶液体积为200g/1.20g/mL=1/6L,则盐酸的物质的量浓度是2mol/1/6L=12mol/L。
(3)制取粗硅是用碳还原二氧化硅,其方程式为SiO2+2C Si(粗)+2CO↑,石英的主要成分是SiO2,与烧碱反应制取水玻璃,反应的离子方程式为SiO2+2OH-=SiO32-+H2O。
Si(粗)+2CO↑,石英的主要成分是SiO2,与烧碱反应制取水玻璃,反应的离子方程式为SiO2+2OH-=SiO32-+H2O。
(4)10t这种玻璃中含Na2O1.3t,CaO1.17t,SiO27.53t,由CaCO3~CaO可计算出所需CaCO3的质量,同理可算出纯碱、石英的质量,约为12.65t。
考点:考查化学在实际生产中的应用


科目:高中化学 来源: 题型:填空题
请回答下列实验室中制取气体的有关问题。
(1)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。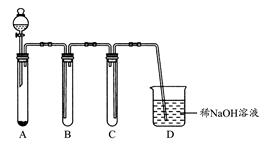
装置B,C,D的作用分别是:B ;C ;D 。
(2)在实验室欲制取适量NO气体。
①下图中最适合完成该实验的简易装置是 (填序号);
②根据所选的装置完成下表;(不需要的可不填)
| | 应加入的物质 | 所起的作用 |
| A | | |
| B | | |
| C | | |
| D | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流等等。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是 (可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体
Ⅱ.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水,有刺激性气味,对人的呼吸系统有损伤,可与碱发生作用。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
(1)写出电解时发生反应的化学方程式 ;
(2)除去ClO2中的NH3可选用的试剂是 (填序号);
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,再加3 mL足量硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收(假设吸收完全);将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定(I2+2S2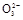
 2I-+S4
2I-+S4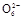 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。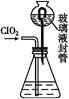
①装置中玻璃液封管的作用是 ;
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨气既是一种工业产品,也是一种重要的工业原料。在工农业生产中具有广泛的用途。
(1)工业合成氨是在________(填工业设备名称)中完成的,某合成氨工厂一天中通入的N2为20 t,通入的H2为3 t,那么这一天生产的NH3可能为________t。
a.23 b.24.3 c.17 d.6
(2)合成氨的原料气氮气来自大气,工业上从空气中分离出氮气的方法有物理方法和化学方法。物理方法是________,化学方法是___________________。
(3)合成氨的原料气氢气主要来自煤的气化,气化过程中除得到氢气外,还得到另外一种燃料气,这种燃料气的化学式为________。
(4)我国化学家侯德榜改革国外的纯碱生产工艺,发明了“侯氏制碱法”。该法制碱是向饱和食盐水中通入NH3和CO2,在实际工业生产中,这两种气体的通入顺序是________,“侯氏制碱法”的副产品可作农业生产的化肥,该副产品是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨气是一种重要的工业产品,也是一种重要的化工原料。为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
(1)实验室中往往采用熟石灰与氯化铵制备氨气,写出该反应的化学方程式(注明反应条件)___________________________________________________________。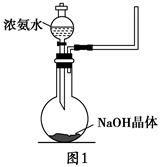
(2)实验室中还可以采用如图1装置(略去了夹持装置)和药品快速制备氨气:
①甲同学不明白该方法中制备氨气的原理,于是学习小组内成员展开了讨论,得出了下面的结论,其中不正确的是________(填字母序号)。
a.氨水中的NH3·H2O分解
b.氨水中存在可逆反应:NH3·H2O NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
c.反应原理与铵盐、熟石灰制备氨气的反应原理相同
d.NaOH溶于水放出热量,使NH3·H2O分解
②乙同学取质量分数为34%的0.89 g·mL-1的浓氨水10 mL,用过量的NaOH与之混合,然后用500 mL的烧瓶收集氨气。请你计算最多可收集满标准状况下的氨气________个烧瓶。
(3)丙同学进行氨气的喷泉实验探究。
①收集氨气时需要用干燥剂干燥,如图2,装置B中盛装的干燥剂是________。
②该同学利用图3装置,成功地完成了喷泉实验。请你简要地写出该同学操作的正确方法:__________________________________________________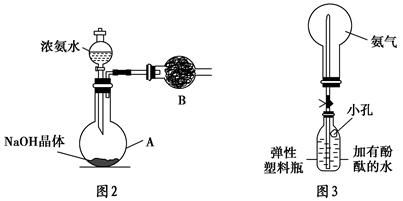
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)将复杂硅酸盐改写成氧化物形式:KAlSi3O8:________________。
(2)有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①将白色粉末加水溶解,得无色溶液。
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B。
根据上述现象判断:
①A的化学式是 B的化学式是 。
②原白色粉末中一定含有 ,可能含有 ,对可能含有的物质,可通过 (填实验名称)进一步检验。检验操作步骤有:①蘸取待测液②置于酒精灯火焰上灼烧 ③透过蓝色钴玻璃观察 ④用稀盐酸洗净铂丝。其中正确的操作顺序为 。
A.①②③④ B.④①②③ C.④②①②③④ D.①③②④
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。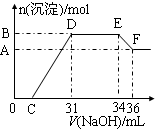
试回答下列问题:
(1)写出反应过程中DE段的离子反应方程式: ,EF段生成含氧元素离子的名称是 。
(2)合金中铁的质量为 g 。
(3)C的值为 mL。
(4)硝酸溶液的物质的量浓度为 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:
______________________________________________________________。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。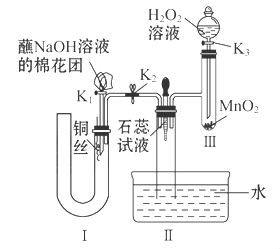
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至 后,迅速关闭K1,观察到U形管内的现象是____________________________________________________。
②装置Ⅲ中发生反应的化学方程式为_______________________________。
③蘸NaOH溶液的棉花团的作用是___________________________________。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一瓶无色干燥的混合气体,可能由HCl、NO、NO2、CO2、NH3、H2、O2、Cl2中的几种混合而成,根据下列实验现象:
①把混合气体通过浓硫酸时,气体体积明显减小;②再通过碱石灰时,体积又明显减小;③剩余气体接触空气时,立即变为红棕色.则:
(1)混合气体中一定存在 ,
(2)一定不存在 ,
(3)可能存在 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com