
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如下图所示,下列判断正确的是

A.a、c两点溶液的导电能力相同
B.b点溶液中![]()
C.a、b、c三点溶液水的电离程度![]()
D.与等体积b、c处溶液恰好完全反应,消耗等量的NaOH
【答案】C
【解析】
盐酸溶液中的氢离子主要是盐酸电离出来的,盐酸完全电离,体积和pH都相同的盐酸和氯化铵溶液加水稀释的过程中,盐酸不能继续电离,盐酸溶液中氢离子浓度变化大;水解是微弱的,氯化铵溶液中铵离子可水解,溶液中的氢离子浓度变化小,所以含c点的曲线pH变化是盐酸溶液的,含a、b点的曲线pH变化是氯化铵溶液的。
A.溶液的导电能力和溶液中自由移动离子的浓度有关,当溶液的体积相等时,a、c两点溶液的离子浓度不一样,所以导电能力不一样,选项A错误;
B.b点溶液中,根据质子守恒,得出![]() ,选项B错误;
,选项B错误;
C.盐酸电离出的氢离子浓度抑制了水的电离,所以c点溶液中水的电离程度最小;水解促进水的电离,由于氯化铵溶液中的氢离子浓度来自于铵根离子水解生成的氢离子,氢离子浓度越大,说明水解程度越大,水的电离程度越大,a点的![]() 点的pH,说明a点酸性大于b点酸性、a点氢离子大于b点氢离子,所以a、b二点溶液水的电离程度
点的pH,说明a点酸性大于b点酸性、a点氢离子大于b点氢离子,所以a、b二点溶液水的电离程度![]() ,综上所述a、b、c三点溶液水的电离程度
,综上所述a、b、c三点溶液水的电离程度![]() ,选项C正确;
,选项C正确;
D.虽然b、c两处pH相同,但是c处溶液中的氢离子是完全电离出来的,而b处的溶液中只有部分铵根离子发生了水解使溶液的pH与c处相等,实际氯化铵的浓度远大于盐酸的浓度,所以消耗NaOH的量是![]() ,选项D错误。
,选项D错误。
答案选C。


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
【题目】磷酸氯喹(结构如图所示)可用于治疗新冠肺炎,临床证明磷酸氯喹对治疗“新冠肺炎”有良好的疗效。2020年3月4日印发的《新型冠状病毒肺炎诊疗方案(试行第七》版中)明确规定了其用量。磷酸氯喹的结构如图所示,下列关于磷酸氯喹的说法错误的是
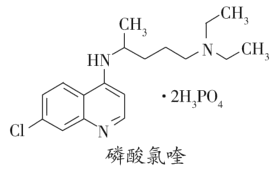
A.化学式为C18H33ClN3O8P2
B.1mol磷酸氯喹能与5molH2发生加成反应
C.分子中的—C1被—OH取代后的产物能与溴水作用
D.可以发生取代反应、加成反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。
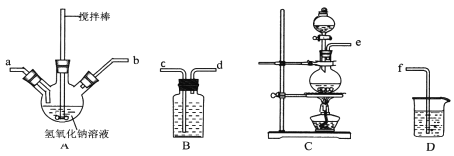
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
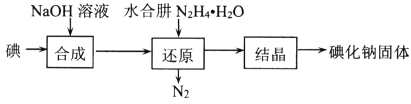
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸盐与钴(Ⅲ)形成的一种配合物[Co(NH3)5NO2]Cl2的制备流程如下:
CoCl2·6H2O![]() [Co(NH3)5Cl]Cl2
[Co(NH3)5Cl]Cl2![]() [Co(NH3)5NO2]Cl2
[Co(NH3)5NO2]Cl2
(1)Co2+基态核外电子排布式为___。
(2)配合物[Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为___(填元素符号);配离子[Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为___。
(3)NO![]() 的空间构型为___,与它互为等电子体的分子为___(写化学式)。
的空间构型为___,与它互为等电子体的分子为___(写化学式)。
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为___。
(5)1mol[Co(NH3)5Cl]Cl2中含有σ键的数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.常温下,0.1 mol/L Na2S溶液中存在:c(OH﹣)=c(H+)+c(HS﹣)+c(H2S)
B.0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) >c(H+)
C.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH﹣)/c(NH3·H2O)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠是一种用途极广的强氧化剂,工业上可以用铬铁矿[主要成分为Fe(CrO2)2或FeO·Cr2O3,还含有Al2O3、Fe2O3、SiO2等杂质]制备,其主要工艺流程如图所示。请回答下列问题:

(1)煅烧铬铁矿生成Na2CrO4的化学方程式为______________________。
(2)调节溶液的pH所选的试剂为___________(填名称),写出生成Al(OH)3的化学方程式______________________。
(3)Na2CrO4溶液酸化时发生反应2CrO42-(黄色)+2H+![]() Cr2O72-(橙红色)+H2O。
Cr2O72-(橙红色)+H2O。
①该反应___________氧化还原反应(填“是”或“不是”),反应的平衡常数表达式:K=___________。
②若向Na2Cr2O7溶液(橙红色)中加入足量的NaOH固体,溶液___________(填标号)
A 变黄色 B 颜色不变 C 变红色溶液
③已知:25℃时,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7,的Ksp=2×10-7。25℃时,向Na2Cr2O7溶液中加入AgNO3溶液,生成砖红色沉淀,且溶液酸性增强,该沉淀的化学式是___________。
(4)用重铬酸钠(Na2Cr2O7)结晶后的母液生产重铬酸钾的反应为Na2Cr2O7+2KCl=K2Cr2O7+2NaCl,结合溶解度图回答,冷却结晶析出大量K2Cr2O7的原因是___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。

已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
请回答下列问题:
(1)写出Na2SiO3的一种用途________________________。
(2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
①最好选用盐酸和________两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式_______________________________________________。
(3)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH=b发生反应的离子方程式为___________________________________________;
检验Fe3+是否沉淀完全的操作方法是_________________________________________。
(4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
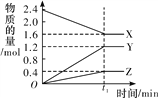
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.转化器中使用适宜的温度
D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:2SO2(g)+![]() O2(g)
O2(g)![]() 2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体之间进行“对流”。请简单描述吸收塔中反应物之间是怎样对流的。______________________________。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com