
【题目】FeCl3 具有净水作用,请回答下列问题:
(1)FeCl3净水的原理是_____________(用离子方程式表示)。
(2)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入_____。
(3)工业上由CuCl2·2H2O晶体制备无水CuCl2的合理方法是在HCl气氛中加热,若在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是_________ (用化学方程式表示)。
(4)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:①取0.36 g试样溶于水,加入过量KI固体,发生反应:2Cu2++4I- = 2CuI↓+I2,生成白色沉淀。②用0.100 0 mol·L-1Na2S2O3标准溶液滴定生成的I2,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。(已知:I2+2S2O32- = S4O62-+2I-)
①滴定过程可选用________作指示剂,滴定终点时的现象是_______________________。
②该试样中CuCl2·2H2O的质量分数为______。
【答案】Fe3++3H2OFe(OH)3(胶体)+3H+ CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3 CuCl2·2H2O![]() Cu(OH)2+2HCl 淀粉溶液 滴入最后一滴标准液,溶液蓝色褪去,且半分钟内不恢复蓝色 95%
Cu(OH)2+2HCl 淀粉溶液 滴入最后一滴标准液,溶液蓝色褪去,且半分钟内不恢复蓝色 95%
【解析】
(1)铁离子水解生成氢氧化铁胶体,具有吸附性,能吸附水中悬浮的杂质而净水;
(2)调节溶液的pH,除去铁离子,同时不能引入新杂质;
(3)由于CuCl2在加热过程中水解被促进;
(4)①Na2S2O3滴定碘单质,利用碘单质遇淀粉变蓝,选择的指示剂为淀粉溶液;滴定终点时的现象是滴入最后一滴标准液,溶液蓝色褪去,且半分钟内不恢复蓝色;
②根据已知反应I2+2S2O32- =S4O62-+2I-,2Cu2++4I- = 2CuI↓+I2,得到关系式
Na2S2O3~Cu2+,再列比例计算。
(1)铁离子水解生成氢氧化铁胶体,具有吸附性,能吸附水中悬浮的杂质而净水,则FeCl3净水的原理是Fe3++3H2OFe(OH)3(胶体)+3H+;
故答案为:Fe3++3H2OFe(OH)3(胶体)+3H+;
(2)为得到纯净的CuCl22H2O晶体,要除去氯化铁,溶液中的Fe3+转化为Fe(OH)3沉淀,加入的物质能与酸反应能转化为氯化铜,且不引入新杂质,可以是CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3;
故答案为:CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3;
(3)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,生成氢氧化铜,而不是CuCl2,要想得到较纯的无水氯化铜应在氯化氢气流中加热抑制其水解;
故答案为:CuCl2·2H2O![]() Cu(OH)2+2HCl;
Cu(OH)2+2HCl;
(4)①Na2S2O3滴定碘单质,利用碘单质遇淀粉变蓝,选择的指示剂为淀粉溶液;滴定终点时的现象是滴入最后一滴标准液,溶液蓝色褪去,且半分钟内不恢复蓝色;
故答案为:淀粉溶液;滴入最后一滴标准液,溶液蓝色褪去,且半分钟内不恢复蓝色;
②某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:①取0.36 g试样溶于水,加入过量KI固体,发生反应:2Cu2++4I- = 2CuI↓+I2,生成白色沉淀。②用0.100 0 mol·L-1Na2S2O3标准溶液滴定生成的I2,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL,发生的反应是I2+2S2O32- = S4O62-+2I-,依据I2+2S2O32- =S4O62-+2I-,2Cu2++4I- = 2CuI↓+I2,得到关系式
Na2S2O3 ~ Cu2+
1 1
0.1000mol/L×0.0200L 0.002mol
则CuCl22H2O的物质的量为:0.002mol,试样中CuCl22H2O的质量分数为![]() ;
;
故答案为:95%。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集与利用是实现温室气体减排的重要途径之一。
(1)目前工业上使用的捕碳剂有 NH3 和(NH4)2CO3,它们与 CO2 可发生如下可逆反应:
2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) K1
(NH4)2CO3(aq) K1
NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) K2
NH4HCO3(aq) K2
(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) K3
2NH4HCO3(aq) K3
则 K3=________(用含 K1、K2 的代数式表示)。
(2)利用 CO2 制备乙烯是我国能源领域的一个重要战略方向,具体如下:
方法一:
CO2 催化加氢合成乙烯,其反应为:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H=a kJ·mol-1起始时按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:
C2H4(g)+4H2O(g) △H=a kJ·mol-1起始时按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:

①a______0(选填“>”或“<”)。
②下列说法正确的是______(填字母序号)。
A 、使用催化剂,可降低反应活化能,加快反应速率
B 、其它条件不变时,若扩大容器容积,则 v正减小,v逆增大
C 、测得容器内混合气体密度不随时间改变时,说明反应已达平衡
③393 K下,H2的平衡转化率为________(保留三位有效数字)。
④393 K下,该反应达到平衡后,再向容器中按 n(CO2)∶n(H2)=1∶3 投入 CO2 和 H2 ,则n(H2)/n(C2H4)将____(填“变大”、“不变”或“变小”)。
方法二:
用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图乙所示。
⑤b电极上的电极反应式为_______。
⑥该装置中使用的是__________(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一。
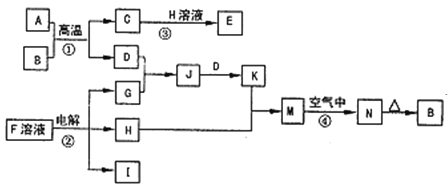
请回答下列问题:
(1)H的电子式是___,其中含有的化学键类型是___。
(2)写出反应④的现象:___,有关反应的化学方程式为___。
(3)已知I的燃烧热是-285.8kJmol-1,则1m3(标准状况)I完全燃烧,恢复至室温时放出的热量是__(计算结果保留3位有效数字)。
(4)25℃时,以Pt为电极电解含有少量酚酞的F的饱和溶液,则在___(填“阴”或“阳”)极附近溶液由无色变为红色,若在此极收集到0.2g气体,则此时溶液的pH是__(假设溶液的体积为2L且不考虑电解后溶液体积的变化)。
(5)在K溶液中加入与K等物质的量的Na2O2,恰好使K转化为N。写出该反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用。CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) ![]() CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
物质 | CO | H2 | CH3OH |
浓度/(mol·L-1) | 0.9 | 1.0 | 0.6 |
(1)反应达到平衡时,CO的转化率为________。
(2)该反应的平衡常数K=________。
(3)恒温恒容条件下,可以说明反应已达到平衡状态的是________(填字母)。
A.v正(CO)=2v逆(H2)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(4)若将容器体积压缩到1 L,则达到新平衡时c(H2)的取值范围是__________。
(5)若保持容器体积不变,再充入0.6 mol CO和0.4 mol CH3OH,此时v正__v逆(填“>”“<”或“=”),平衡_____________移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是地壳中含量非常丰富的元素,金属铁是在高炉中冶炼的,在冶金工业中,常用焦炭来冶炼铁。
(1)写出焦炭在高炉中所参加的两个反应的化学方程式: ________________。
(2)写出赤铁矿被![]() 还原成铁的化学方程式:__________________________。
还原成铁的化学方程式:__________________________。
(3)实验室中可用![]() 还原
还原![]() ,在加热
,在加热![]() 前应先_________,否则可能发生________现象;未反应完的
前应先_________,否则可能发生________现象;未反应完的![]() ___________(填“能”或“不能”)排放到大气中,应做________处理。
___________(填“能”或“不能”)排放到大气中,应做________处理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学又称环境友好化学,它的主要特点之一是提高原子的利用率,使原料中所有的原子全部 转化到产品中,实现“零排放”。下列反应符合绿色化学这一特点的是
A. 工业冶炼 Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
B. 用生石灰制熟石灰 CaO+H2O=Ca(OH)2
C. 实验室制取二氧化碳 CaCO3+2HCl=CaCl2+H2O+CO2↑
D. 实验室制取氢气 Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,纯水中存在的平衡:H2O ![]() H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 加入稀盐酸,平衡逆向移动,c(H+)降低
C. 加入氢氧化钠溶液,平衡逆向移动,Kw变小
D. 加入少量固体CH3COONa,平衡正向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如下:

请回答下列问题:
(1)已知:6.0 g化合物E完全燃烧生成8.8 g CO2和3.6g H2O;E蒸气的密度标准状况下约为2.68g/L,则E的分子式为____________。
(2)A为一取代芳香烃,B中含有一个甲基。由B生成C的化学方程式为___________________。
(3)由B生成D、由C生成D的反应条件分别是________、________。
(4)由A生成B、由D生成G的反应类型分别是________、________。
(5)F存在于栀子香油中,其结构简式为_________________________。
(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有________种,其中核磁共振氢谱有两组峰,且峰面积比为1∶1的是____________(填结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com