
【题目】二氧化碳的捕集与利用是实现温室气体减排的重要途径之一。
(1)目前工业上使用的捕碳剂有 NH3 和(NH4)2CO3,它们与 CO2 可发生如下可逆反应:
2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) K1
(NH4)2CO3(aq) K1
NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) K2
NH4HCO3(aq) K2
(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) K3
2NH4HCO3(aq) K3
则 K3=________(用含 K1、K2 的代数式表示)。
(2)利用 CO2 制备乙烯是我国能源领域的一个重要战略方向,具体如下:
方法一:
CO2 催化加氢合成乙烯,其反应为:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H=a kJ·mol-1起始时按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:
C2H4(g)+4H2O(g) △H=a kJ·mol-1起始时按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:

①a______0(选填“>”或“<”)。
②下列说法正确的是______(填字母序号)。
A 、使用催化剂,可降低反应活化能,加快反应速率
B 、其它条件不变时,若扩大容器容积,则 v正减小,v逆增大
C 、测得容器内混合气体密度不随时间改变时,说明反应已达平衡
③393 K下,H2的平衡转化率为________(保留三位有效数字)。
④393 K下,该反应达到平衡后,再向容器中按 n(CO2)∶n(H2)=1∶3 投入 CO2 和 H2 ,则n(H2)/n(C2H4)将____(填“变大”、“不变”或“变小”)。
方法二:
用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图乙所示。
⑤b电极上的电极反应式为_______。
⑥该装置中使用的是__________(填“阴”或“阳”)离子交换膜。
【答案】![]() < A 67.4% 变小 2CO2+12H++12e-=C2H4+4H2O 阳
< A 67.4% 变小 2CO2+12H++12e-=C2H4+4H2O 阳
【解析】
(1)① 2NH3(l)+H2O(l)+CO2(g)═(NH4)2CO3(aq) K1
② NH3(l)+H2O(l)+CO2(g)═NH4HCO3(aq) K2
根据盖斯定律②×2-①可得:(NH4)2CO3(aq)+H2O (l)+CO2(g)2NH4HCO3(aq),因此 K3=![]() ;
;
(2)①由图甲可知,升高温度,氢气的物质的量增多,平衡逆向移动,则正反应为放热反应,a<0;
②A.使用催化剂,可降低反应活化能,加快反应速率,选项A正确;
B.其它条件不变时,若扩大容器容积,则v正减小,v逆减小,选项B错误;
C.反应前后气体质量不变,恒容条件下密度始终不变,密度不变不能说明反应已达到平衡,选项C错误;
D.反应使用合适的催化剂,催化剂改变反应历程加快反应速率,不改变化学平衡,不改变反应焓变,选项D错误;
答案选A;
③图象分析可知,393K时平衡状态下水、H2的物质的量分别为58mol、42mol,生成58molH2O必然消耗87molH2,则初始时H2的物质的量为(87+42)mol=129mol,则H2的转化率为![]() ×100%=67.4%;
×100%=67.4%;
④393K下,该反应达到平衡后,再向容器中按n(CO2):n(H2)=1:3投入CO2和H2,相当于增大压强,平衡正向移动,所以则n(H2)/n(C2H4)将变小;
⑤电解时,二氧化碳在b极上得电子发生还原反应生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O;
⑥离子交换只允许氢离子通过,所以是阳离子交换膜。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:

(1)打开K2,闭合K1,若所盛溶液为CuSO4溶液:则A为________极,B极的电极反应式为__________。
(2)打开K1,闭合K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是__________,总反应化学方程式是_________。
(3)如要用电解方法精炼粗铜,打开K1,闭合K2,电解液选用CuSO4溶液,则A电极的材料应换成是______,反应一段时间后电解质溶液中Cu2+浓度_____(填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A. 使用催化剂 B. 适当提高氧气的浓度
C. 适当提高反应的温度 D. 适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。
(资料)①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:
化学键 | H—H | O=O | H—O |
键能 | 436 | 496 | 463 |
请填写表:
化学键 | 填“吸收热量”或“放出热量” | 能量变化 | |
拆开化学键 |
| ______ | ____ |
| ______ | ____ | |
形成化学键 |
| ______ | ____ |
总能量变化 | ______ | ____ | |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是__________________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是__________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol/L盐酸滴入20.00 mL 1.000 mo1/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )

A. a点由水电离出的c(H+) = 1.0 × 10-14 mo1/L
B. b点:c(NH4+) > c(Cl-) > c(OH-) > c(H+)
C. c点:盐酸与氨水恰好完全反应
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O35H2O)俗称海波或大苏打,是一种重要的工业试剂。
(1)硫代硫酸钠加热至310℃分解,生成硫和亚硫酸钠,写出反应的化学方程式_______,该反应为吸热反应,说明断裂反应物化学键时所吸收的总能量_____形成生成物化学键时所放出的总能量(填 “大于”、“等于”或 “小于”)。硫代硫酸钠在酸性条件下发生如下反应Na2S2O3+H2SO4=Na2SO4+H2O+SO2↑+S↓,每生成4g S转移的电子数为________。
(2)向热的硫化钠和亚硫酸钠混合液中通入二氧化硫,可制得硫代硫酸钠晶体:2Na2S+Na2SO3+3SO2+5H2O![]() 3Na2S2O35H2O。
3Na2S2O35H2O。
①下列能判断制取硫代硫酸钠的反应达到平衡状态的是_________
A.Na2S和Na2SO3的浓度不再发生变化
B.在单位时间内生成0.03mol Na2S2O35H2O,同时消耗了0.02molNa2S
C.v(Na2S): v (Na2SO3) =2:1
②制备过程中,为提高硫代硫酸钠的产量,通入的SO2不能过量,原因是_____。
(3)某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下表:
组号 | 反应温度(℃) | 参加反应的物质 | ||||
Na2S2O3 | H2SO4 | H2O | ||||
V/mL | c/molL-1 | V/mL | c/molL-1 | V/mL | ||
A | 10 | 10 | 0.1 | 10 | 0.1 | 0 |
B | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
C | 10 | 5 | 0.2 | 10 | 0.2 | 5 |
D | 30 | 5 | 0.1 | 10 | 0.1 | 5 |
①上述实验中能够说明反应物浓度对反应速率影响的组合是___________。
②能够说明温度对反应速率影响的组合是_______。
(4)某些多硫化钠可用于制作原电池(如图所示),该电池的工作原理是:2Na2S2+NaBr3=Na2S4+3NaBr
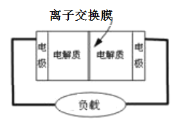
①电池中左侧的电极反应式为Br3- + 2e-= 3Br-,则左侧电极名称是_____________(填“正极”或“负极”)。
②原电池工作过程中钠离子__________(选“从左到右”或“从右到左”)通过离子交换膜。
③原电池工作过程中生成的氧化产物是___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是

A. Ksp〔Fe(OH)3〕<Ksp〔Cu(OH)2〕
B. 加适量浓NH3·H2O可使溶液由a 点变到b点
C. c、d两点代表的溶液中c(H+) 与c(OH-)乘积不相等
D. Fe(OH)3在d点代表的溶液过饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4是制备高纯MnCO3的中间原料。实验室用如图所示装置可制备少量MnSO4溶液,反应原理为MnO2+H2SO3=MnSO4+H2O。下列说法错误的是( )
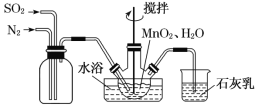
A. 若实验中将N2换成空气,则反应液中 的浓度之比变大
的浓度之比变大
B. 缓慢通入混合气体可提高SO2的转化率
C. 若不通N2,则烧瓶中的进气管口容易被堵塞
D. 石灰乳对尾气的吸收效果比澄清石灰水更好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们的生产生活联系紧密,下列有关说法不正确的是( )
A. 人工固氮过程和乙酸乙酯的制备反应均为有限度的
B. 用漂白粉进行泳池消毒和用铁罐保存冷的浓硫酸都利用了化学物质的强氧化性
C. 高炉炼铁和用粮食酿酒的化学反应中都有二氧化碳生成
D. 豆浆的丁达尔效应和肥皂的去污过程发生的均为化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com